#EU GMP #EU GMP 附录
德恩的专家们,在合规性工作中,特别是在协助需满足EU GMP以及PIC/S GMP合规性项目的时候,常常碰到和讨论一些有趣的知识点。这些不仅仅是我们客户碰到的问题,相信在大家的日常工作中也会遇到,今天我们就来看看关于EU GMP无菌附录1中(PIC/S GMP已采用),有哪些比较新的知识点需要我们学习和注意的呢?
01 在洁净室内,是否能够设计滑动门?
EU GMP附录1中第4.6条:
“To reduce accumulation of dust and to facilitate cleaning there should be no recesses that are difficult to clean effectively, therefore projecting ledges, shelves, cupboards and equipment should be kept to a minimum. Doors should be designed to avoid recesses that cannot be cleaned. Sliding doors may be undesirable for this reason.
为了减少灰尘的积聚并便于清洁,不应有难以有效清洁的凹槽,因此应最大限度减少突出的窗台,架子,柜子和设备。门的设计应避免无法清洁的凹槽。由于这个原因,滑动门可能是不被期望的。”
中国GMP无菌药品附录第二十八条:
“为减少尘埃积聚并便于清洁,洁净区内货架、柜子、 设备等不得有难清洁的部位。门的设计应当便于清洁。”
注意
原则上来说,滑动门的设计需要注意了。特别是无菌产品的生产区域,这是不受官方“待见”的方式。对于其他类型产品如口服固体类,我们也是建议尽量避免,但当不可避免的情况下,是一定需要考虑设计上便于清洁的。
02 关于洁净室内日常监控及监控设施的要求。
EU GMP附录1中第4.17条:
“Facilities should be designed to permit observation of production activities from outside the grade A and B areas (e.g. through the provision of windows or remote cameras with a full view of the area and processes to allow observation and supervision without entry). This requirement should be considered when designing new facilities or during refurbishment of existing facilities.
设施的设计应允许从A级和B级区域之外观察生产活动 (例如,通过安装窗或远程摄像机,可以全面查看该区域和过程,以便在不进入的情况下进行观察和监督)。在设计新设施或翻新现有设施时,应考虑这一要求。”
中国GMP无菌药品附录第十九条:
“洁净区内的人数应当严加控制,检查和监督应当尽可能在无菌生产的洁净区外进行。”
注意
EU GMP 附录1对于设施部分相对来说提出了更细化的要求。实际上很多企业是按照这种方式提供监督的措施,但也遇到部分企业在设计的时候欠缺了这部分的考虑。如果我们企业是有国际化布局的时候,需要注意这些设计要求。
除此之外,让我们同时也结合看看EU附录1中对于监督管理本身提出的要求:
“9.27 Where monitoring is routinely performed by manufacturing personnel, this should be subject to regular oversight by the quality unit (refer also to paragraph 8.19).
如果日常监测工作由生产人员进行,则应由质量部门定期监督。”
“8.19 Aseptic operations (including APS) should be observed on a regular basis by personnel with specific expertise in aseptic processing to verify the correct performance of operations including operator behaviour in the cleanroom and address inappropriate practices if detected.
无菌操作(包括APS)应由在无菌方面具有特定专业知识的人员定期观察以确认操作的正确性能, 包括洁净室中操作人员的行为,并处理不适当的做法(如有)。”
“For RABS, gloves used in the grade A area should be sterilised before installation and sterilised or effectively bio-decontaminated by a validated method prior to each manufacturing campaign.
对于RABS,在A级区域使用的手套应在安装前进行灭菌,并在每次制造活动之前通过经验证的方法进行灭菌或有效消毒。”
注意
对于RABS在A级区域使用的手套,特别要注意其要求是在安装前进行了灭菌。
03 关于D级别的粒子是否需要动态检测?
EU GMP附录1中:
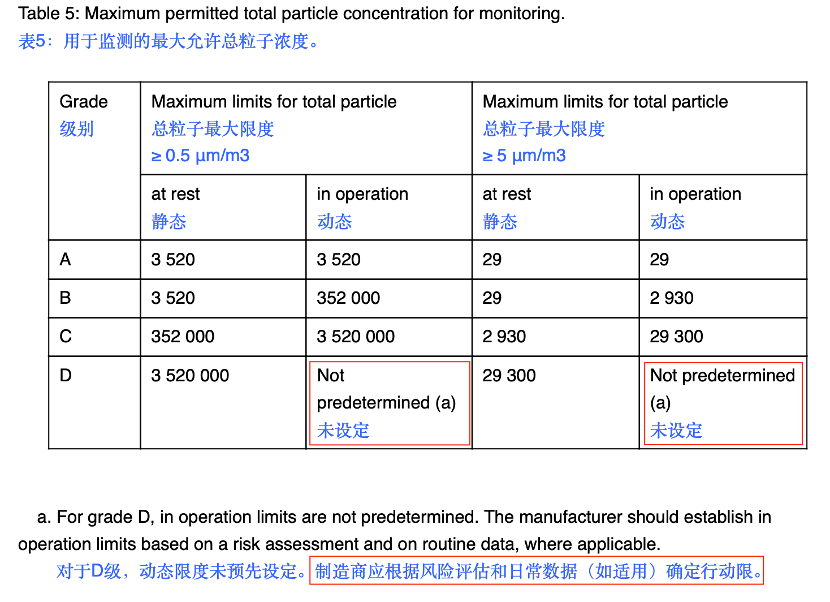
图1 EU GMP附录1内容
注意
在中国GMP中无菌附录中,对这个点未做明确的规定和说明。但是对于EU的附录1,明确指出了即便其限度并未进行预定义,但是工厂应该根据情况,比如已运行的工厂过往的日常监控数据,来确定行动限的哟!如果是新工厂,也是需要评估给出一个限度来做监控,并收集数据进行更新。这个点需要真的注意了