#药物警戒质量体系 #质量体系
导读
《药物警戒质量管理规范》中指出,药物警戒活动是指对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制的活动。药物警戒工作贯穿于药物临床试验和上市后阶段,药品上市许可持有人和获准开展药物临床试验的申办者都应当建立药物警戒体系,通过体系的有效运行和维护,监测、识别、评估和控制药品不良反应及其他与用药有关的有害反应。
在这里,德小恩总结了国内相关的药物警戒法规指南以及药物警戒体系文件对应的法规指南,希望能帮助到想了解此版块的每位同行!
药物警戒法规指南
在国内,在生效期的主要药物警戒相关法规和指南是2010年后陆续发布的,目前总结有14份,分别如下:
2011年
《药品不良反应报告和监测管理办法(部令81号) 》
《药品和医疗反应器械安全突发事件应急预案(试行)》
2012年
《药品定期安全性更新报告撰写规范》
2018年
《药品上市许可持有人直接报告不良反应事宜66号)》
《个例药品不良反应收集和报告指导原则的通告(131号)》
2019年
《药品上市许可持有人药物警戒年度报告撰写指南(试行)》
2020年
《药物警戒委托协议撰写指导原则(试行)》
《上市许可持有人药品不良反应报告表(试行)》
2021年
《药物警戒质量管理规范》
2022年
《药物警戒检查指导原则 》
《药物警戒体系主文件撰写指南》
《药品GVP指南:风险识别、评估与控制 》
《药品GVP指南:监测与报告》
《药品GVP指南:药物警戒体系与质量管理》
中国作为ICH协会成员国之一,ICH发布的药物警戒指导原则对中国也有指导意义。ICH发布的药物警戒相关指导原则主要是E2,其6部分内容分别为:
《ICH E2指南》
E2A:临床安全性数据管理:快速报告
E2B:个例安全报告(ICSR)电子传输
E2C:定期获益-风险评估报告
E2D:上市安全性数据管理:快速报告
E2E:药物警戒计划
E2F:研发期间安全性更新报告
药物警戒体系对应的法规指南
本期总结出药物警戒质量体系的主要元素及文件展示如下:
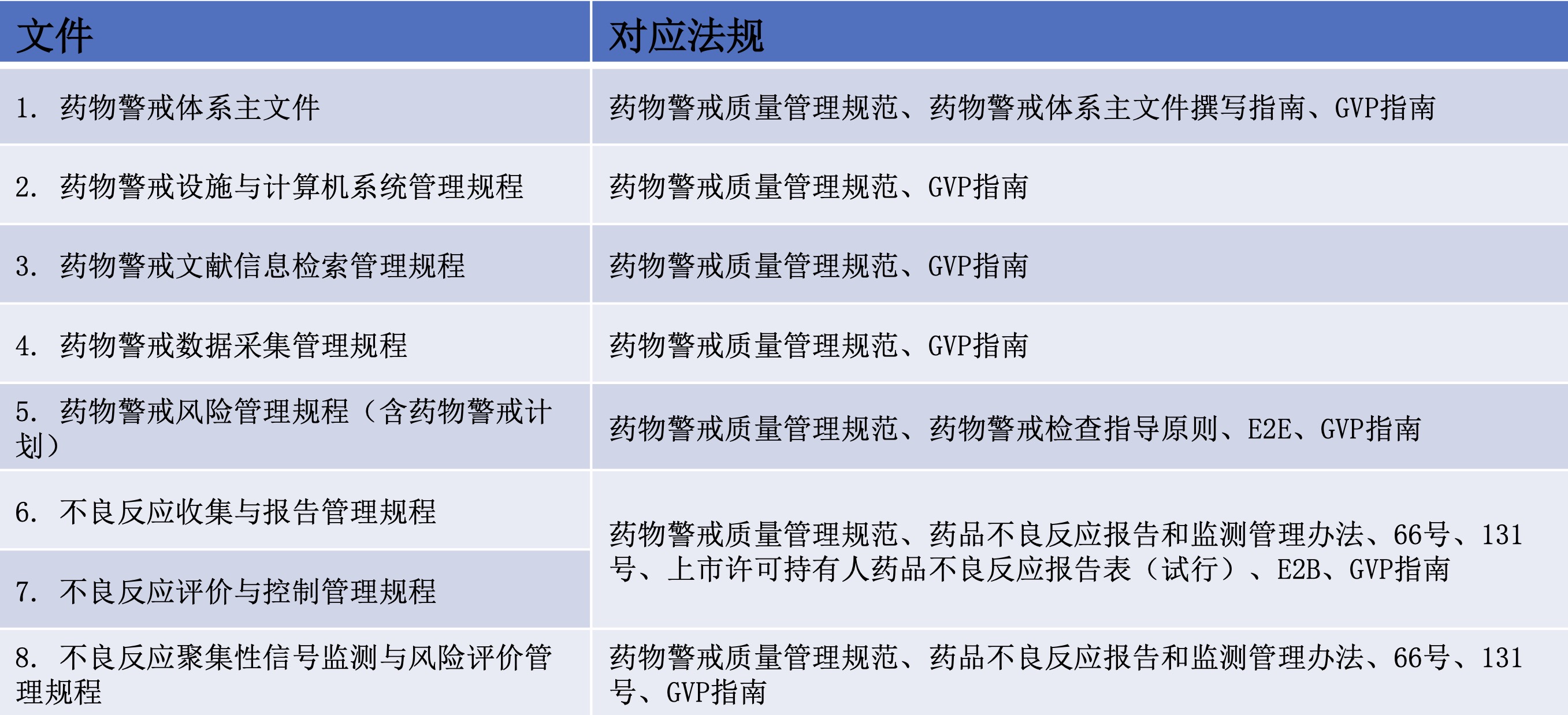
表1 药物警戒体系对应的法规指南(一)
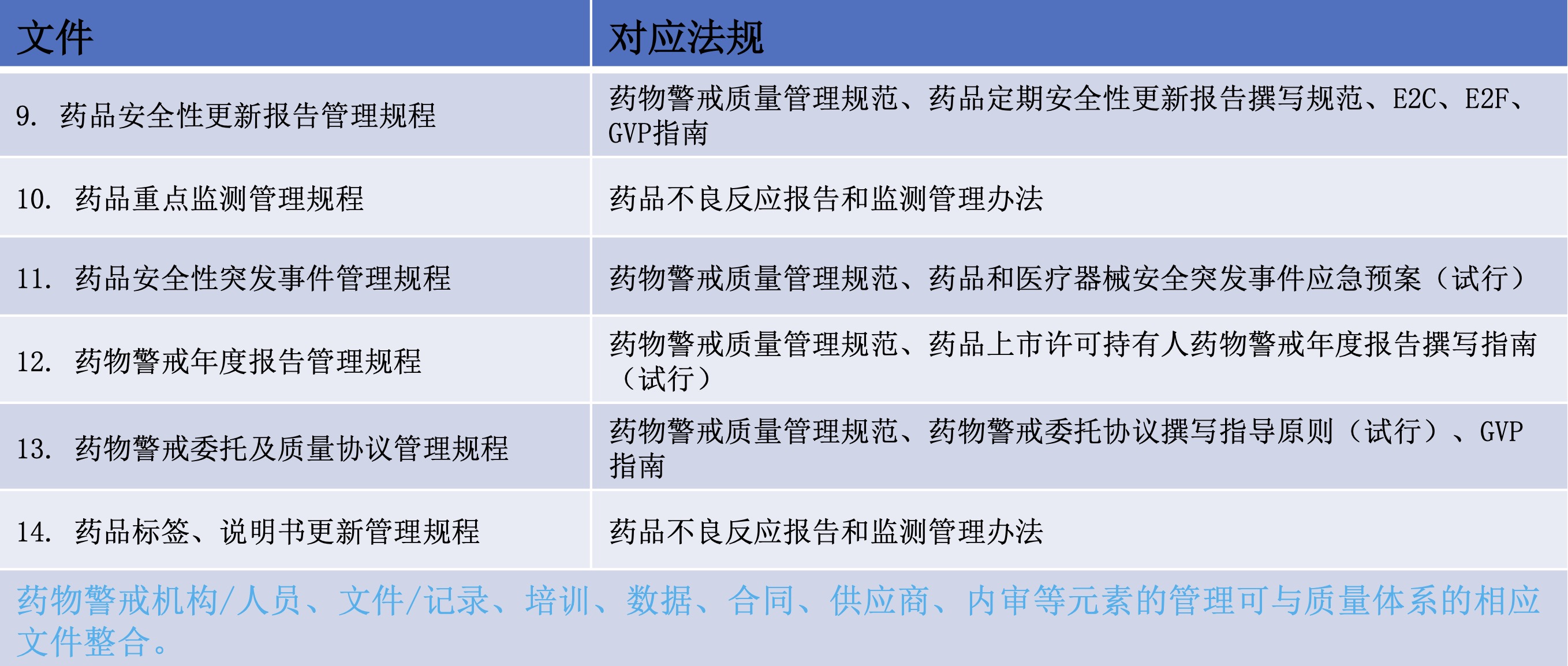
表2 药物警戒体系对应的法规指南(二)
以上是本期的全部内容,如您有相关的问题,可通过邮箱info-cn@gempex.com与我们联系,德恩的GMP专家将为您解答。