#FDA #FDA检查 #GMP检查
2023年8月底,国内某企业收到FDA的信件通知,准备10月中下旬对工厂进行为期5天的现场PAI检查,一石激起千层浪。从通知下发到检查开展,中间除去一个国庆假期,实际上留给企业的准备时间是很短的。接下来,德恩GMP咨询将分享在这为期一个半月的时间,对于一个没有经历过US FDA检查的企业来说,是如何开展的准备活动,最终成功并零缺陷通过的。
声明:本分享是为了帮助小伙伴们在准备FDA检查时或者了解FDA检查的流程等提供一些有价值的内容,但同时需隐去企业的所有信息以保护企业的隐私。
实际上,该企业“意料之外”是因为他们终端客户产品属于无菌制剂药品,注册申报时间线较长,因此对于处于供应链靠前端的企业是不太了解其进度,存在一定的信息差的。
在这里,要注意一点,当企业收到FDA的通知的时候,如果有充分的理由,是并不一定要接受他们指定的时间,这是可以去进行协商的,比如生产计划及安排等。但没有及时回复或者不合理的延迟,则会被认为是违反了US FDA的法规要求,那后果自然比较严重,比如导致产品无法进入美国市场。
以下原文供参阅:

该企业一开始是处于“萌萌哒”的状态,也没多想,非常积极地配合和接受FDA的检查安排的。但其下游客户是“清醒”的,知道检查的压力是很大的 - 时间不多任务还重,因此协助该企业找到德恩进行检查前辅导。
FDA发送通知后,其指派的检察官,随后便对检查的安排及要求,包括对语言要求、需要准备的文件以及现场的安排事项,进行了清晰地罗列求并发送给了企业。这份清单,可以简单把重点挑一些给大家看一看,比如:
19. 生产和仓储区域的布局图
20. 目标产品的工艺流程简图
21. 目标产品生产设备、检验设备清单及其相关信息
22. 目标产品批号编码系统
23. 上次检查因483(如有)发现项的变更和纠正措施清单
检查开始时需要准备的:
其实,对于短时间的检查准备,一定是需要根据企业的情况来制定的,因为每个企业的状态,特别是内在的运营薄弱环节是完全不同的,那如果眉毛胡子一把抓,是效率极低的。需要把精力用在刀刃上。
所以第一步是对工厂进行现场的快速巡查,以了解其内在运营“big picture整体状态”,把握其处于什么样一个位置,比如,人 员的资质及认知度(awareness)情况、质量体系的整体情况、产品质量情况(内核)、记录的情况、现场环境条件(外在)、检查组织能力的情况等等进行一个摸底。
对于该工厂,好的面是其产品工艺和质量属性,内核的部分是问题不大的,多年的经验和历史也算得上业界的佼佼者,此外,公司没有故意造假行为这样的红线问题。虽然如此,但是薄弱环节也是很明显的,特别是因为其产品的产量巨大,在现场环境的维护、文件执行的程度以及记录的规整程度、以及人员因缺少FDA这样的检查经验,导致对于检查主题的敏感度是应该说比较低的。
那策略实际上就比较清晰了:
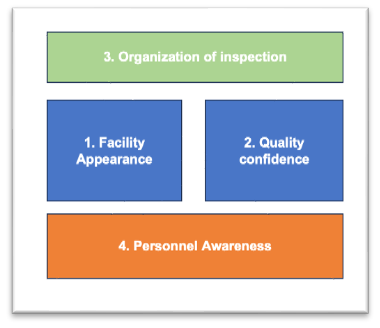
第一:工厂的整体状态需要调整,包括干净、整洁、良好的标识、设施的维护和保养状态
第二:质量信心的筹备,包括其优秀的产品质量对应的证明性资料,产品污染与交叉污染的问题资料、质量管理的重要元素梳理
第三:组织检查开展,比如PPT的准备很重要,参观路线的制定,回答问题的SME指定,前后迎检办公室的准备
第四:人员检查意识上的提升(行为举止及语言)
第五:可能比较关键的问题的应对策略
其原则是,第一印象很重要;然后优秀的地方好好展示;对于有问题的地方需要制定策略;最后就是好好组织引导整个检查过程。
项目的良好运转,与懂GMP技术的优秀项目协调人员是息息相关。大方向定下来,接着就是落地的执行。
首先,计划和任务表很重要。将整个检查涉及到的各环节结合检察官的清单,把任务拆分成各个部门需要完成的工作清单,这张任务单涵盖部门、文件清单、负责人、计划完成时间和完成情况
对任务拆解后,识别负责人是很关键的。他们对手里的任务理解到什么程度,是需要去逐一核对和感知的,因为有时候该模块的负责人可能以为自己知道了,但可能是没有理解到到底要怎么准备和准备到什么程度。
所以,一场动员大会是需要的。第一要动员的是领导层和管理层,第二,动员的是执行层。
管理层实际上从一开始就支持FDA的检查,为什么说还是要动员呢?因为管理层有可能并不完全清楚,需要出多大的支持力度来开展活动,因此,是需要解释清楚当前的情况以及可能出现的结果和影响程度。在通过检查后给企业带来的正面积极效应,当然反面的也会要讲。

当管理层对目标和结果把握准确了,那么执行层面的动员,就会更加落地一些。比如,动员大会上,结合执行层无相关经验,PPT内容需要更“大白话”,比如:
在检查前,各就各位,我们的统筹工作分为两个部分,一个部分是对计划的跟踪和校准,一个部分是对于疑难杂症的问题解决。
每天对工厂进行巡检,查阅整体的环境状态,收集问题清单“punch list”;对工作计划标上的文件及记录进行查阅进度,解决遇到的问题;每隔一天汇报整体的状态和进度,以及收集到的问题情况,并进行策略制定。
整体情况紧锣密鼓按照步骤开展工作,特别是在巡检的时候,同时对现场人员进行“演练”,按照检察官的方式提出问题,看看负责该板块的人员如何回答,及时反馈指导其答复是否能够比较好的响应到检查人员的问题。
检查前一天,我们对工厂进行了最后一次的摸底演练。
这个时候,整体工作的完成已经达到了95%,工厂的状态也是进入了迎检的良好状态。
对于最终演练后,尚存在的少量问题,进行了汇总和汇报,以便领导层知晓把握完整的信息。
以上就是准备的整体过程,从了解企业的情况,到根据情况制定策略,继而衍生行动计划和工作任务,然后逐一落地,到最终验收,形成一条完整的闭环。
07. 检查期间及小总结

检查期间,整个工作从Opening Meeting 到现场检查路线,以及检查过程中各个问题SME的问题回复是非常顺利的。
实际上,从检查员进入工厂的时候,检查员对工厂第一印象感受是非常好的,因为工厂整体干净整洁,井井有条。所以,有时候我们说,工厂的整体环境还是很重要的,能够有一个好的印象,就是一个非常好的开端,以至于可能整体的检查紧张程度也会降下来不少。不过,这也跟工厂的情况相关的,因为产品情况的不同,检查的要求是会有较大差异的,比如,对于无菌制剂,重点当然会偏移更多到无菌保障的主题上来。
此外,在整个检查过程,是由我们专业的GMP专家进行翻译,信息的交互的准确程度就高了很多。每晚进行总结并及时准备第二天需要的文件,每次提供的文件都有安排专人进行复核确认,这些都是必不可少的一些工作。
五天紧张而有序的检查,检查员非常满意并明确了没有发现项。
对于整个检查如此顺利,德恩的客户自己都感到意外。他们对我们此次的整体工作,从组织开展到实施,从现场检查到检查完成后的一些后续响应,都给了大大的赞。
下面是客户的反馈:
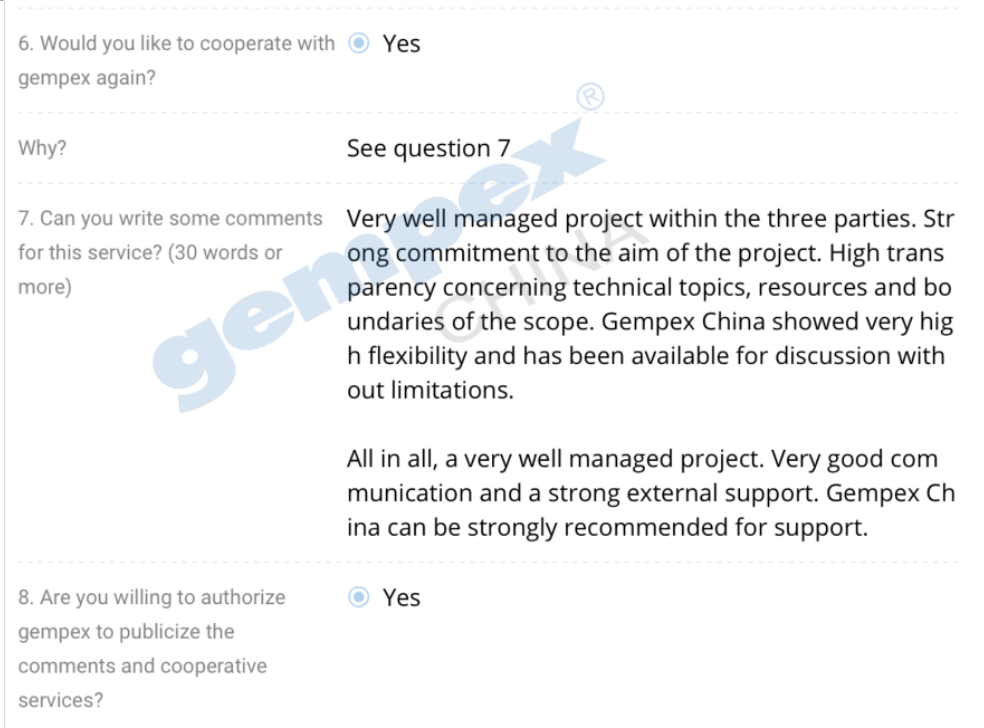
德恩GMP咨询也是感谢客户的支持和信任,也恭喜工厂成功零缺陷通过US FDA检查,希望此次的分享对小伙伴们有帮助!
本文章为德恩原创,如需转载,请注明来源于德恩GMP咨询,否则将进行法律追究。