#基因编辑 #基因治疗
导读
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats,成簇的规律间隔的短回文重复序列)最早被发现于细菌基因中,随后人们惊讶地发现,它能通过RNA介导对DNA的切割作用,竟是细菌的“免疫系统”。随着科学家研究的深入和对该系统的改进,CRISPR/Cas9技术成为了目前人类认识和改造基因中最重要的研究手段,但CRISPR技术还尚未正式应用于医学领域。
今年11月16日,CRISPR基因编辑疗法Casgevy(exagamglogene autotemcel,exa-cel)获得了英国药品和健康产品管理局(MHRA)授予的有条件上市许可,成为了全世界首款获批上市的CRISPR基因编辑疗法,用于治疗镰刀型细胞贫血病(SCD)和输血依赖性β地中海贫血(TDT)。随后,FDA于12月8日也批准了Casgevy疗法。接下来德恩将基于这一疗法,简要地介绍CRISPR基因编辑疗法机制,供您参阅!
01 Casgevy疗法的适应症
镰刀型细胞贫血病(SCD)和输血依赖型β地中海贫血(TDT)是本次介绍的CRISPR基因编辑疗法的适应症,让我们先来了解这两种疾病。
镰刀型细胞贫血病(SCD)是一种常染色体隐性遗传病,因β珠蛋白链第6位的谷氨酸被缬氨酸代替,形成了异常的血红蛋白S(HbS)。SCD主要影响非裔人群,是世界上最常见的遗传性血液贫血之一。在氧分压下降时,HbS导致SCD患者的红细胞扭曲成镰状细胞。镰变的红细胞可发生溶血、堵塞毛细血管等、限制氧气输送到身体组织,引起剧烈疼痛、血管堵塞、贫血等相关症状。这称为血管闭塞事件(VOE)或血管闭塞危象(VOCs),它的反复发生可能导致危及生命的残疾或死亡。
地中海贫血是由于构成血红蛋白的珠蛋白基因突变、缺失导致的珠蛋白链合成减少或完全缺失所引起的遗传性慢性溶血性疾病,广泛流行于地中海盆地、中东、非洲和东南亚。其中最严重的是输血依赖型地贫(TDT),患者的临床症状贯穿患者的生长发育期,包括贫血进行性加重、生长发育迟缓、脾功能亢进、骨骼变形等多种症状,还会导致特殊的“地贫外貌”。
SCD和TDT严重影响了患者的生存质量,是重要的世界性公共健康问题。目前对症治疗是治疗SCD和TDT的主要方法,即持续输血和药物疗法。然而长期反复输血也会导致患者的继发性铁过载,因此也需祛铁治疗。除此以外,骨髓移植是治愈SCD和TDT的唯一选择,然而这不仅需要匹配的捐赠者,患者还必须面对排斥反应的风险。因此直至今日,仍有大量SCD患者和TDT患者的治疗需求未被充分满足。
02 Casgevy疗法的介绍
为了从根本上应对SCD和TDT的治疗需求,科学家已深入研究其内在的发病机制。
正常情况下,人体内的血红蛋白由四个亚基组成,每个亚基包含一条珠蛋白链和一个血红素分子。成年人体内的血红蛋白由98%的HbA(α2β2)和2%的HbA2(α2δ2)组成;然而,胎儿时期,人体内的血红蛋白不含β珠蛋白链,为HbF(α2γ2)。2008年,科学家发现控制胎儿血红蛋白合成的转录调节因子为BCL11A。
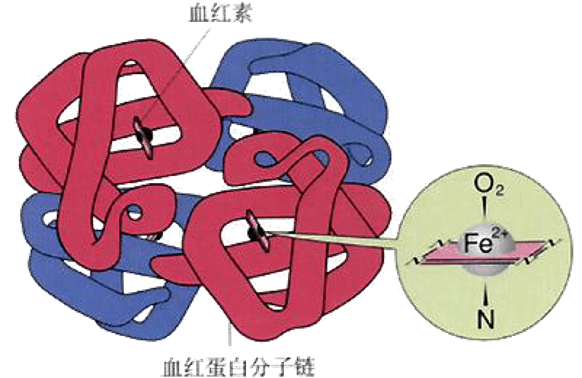
图1 人体血红蛋白的结构
既然SCD和β型TDT的致病基因位点都位于β珠蛋白基因上,因此科学家把目光投向了CRISPR基因编辑技术。科学家希望能开发出安全有效的基因编辑疗法,“修补”或者“绕开”致病的β珠蛋白基因,帮助造血干细胞合成功能正常的血红蛋白。这种基因编辑疗法将直接应用于患者的自体造血干细胞上,无需捐赠者或匹配,因此能“标本兼治”的基因编辑疗法有望造福更广泛的患者群体。
那么,接下来我们来看看,采用全球获批上市的首个CRISPR基因编辑疗法Casgevy是什么?
Casgevy是Vertex Pharmaceuticals和CRISPR Therapeutics由共同开发的基因编辑疗法,具有一次治疗、提供功能性治愈镰刀型细胞贫血病(SCD)的潜力。具体而言,该基因编辑疗法对患者的人造血干细胞和祖细胞使用CRISPR/Cas9技术,在体外编辑其BCL11A基因的红系特异性增强子区,并将经过基因修饰的自体CD34+细胞富集群体注射回患者体内。换言之,Casgevy疗法激发了患者胎儿血红蛋白的合成,通过绕过有缺陷的β珠蛋白基因、生产功能正常的HbF,使红细胞恢复正常功能。
在英国MHRA的批准中,Casgevy疗法的的适应症包括12岁及以上镰刀型细胞贫血病(SCD)伴复发性血管闭塞危象(VOCs)患者,以及无法获得人类白细胞抗原(HLA)匹配造血干细胞移植治疗的输血依赖性β地中海贫血(TDT)患者。然而12月8日,FDA只批准了Casgevy疗法用于治疗12岁及以上患镰刀型细胞贫血病(SCD)并有血管闭塞事件(VOE)病史的患者,另一个适应症的PDUFA日期为2024年3月30日。此外,Casgevy疗法也正在接受欧洲药品管理局(EMA)、沙特食品药品监督管理局等多国药品监管机构的审查。
目前为止,在两项用Casgevy治疗SCD和TDT患者的全球临床试验中,试验都达到了各自的主要终点,即患者至少连续12个月没有发生重度VOC或不需进行输血。临床试验结果还显示,Casgevy具有一次治疗,提供功能性治愈的潜力。其中,治疗的副作用与自体干细胞移植的副作用相似,包括但不限于恶心、疲劳、发烧和感染风险增加,但未发生重大安全问题。
下图为今年3月的第三届人类基因组编辑国际峰会的演讲。其中首位接受Casgevy疗法的镰状细胞贫血病患者维多利亚·格雷(Victoria Gray)女士在此演讲中展现Casgevy疗法对其疾病真实有效。

图2 多利亚·格雷的现场演讲情况
03 基因编辑疗法的展望
从上面我们可以看到Casgevy基因编辑疗法对SCD和TDT疾病是有效的,但目前为止Casgevy的综合临床数据还尚未完整,因此处于英国MHRA有条件上市授权(Conditional marketing authorization, CMAs)状态。考虑到接受Casgevy疗法治疗的患者可能面临着血液癌症的风险,FDA也提出了将对接受治疗的患者进行长期研究,以评估每种产品的安全性和有效性。相信在不久的将来,Casgevy基因编辑疗法会在全球更多地区和国家上市,也相信未来会有更多治疗不同疾病的CRISPR基因编辑疗法出现!
相关资料
FDA Approves First Gene Therapies to Treat Patients with Sickle Cell Disease
More than 200 people have been treated with experimental CRISPR therapies
P.S. 本文章为德恩原创,如需转载,请注明来源于德恩GMP咨询。