2023-07-06
随着国内新药市场国际化的发展,我们的MAH需要关注各个地区的管理要求,并迅速理解和搭建相应的资源。欧洲作为主要市场之一,也是各类创新药关注的重要区域。国内MAH是官方多方考量的综合性制度,与欧洲和美国的管理上还是有较多不同。总体来说,欧洲由于QP制度是可以独立于企业的,因此,在各个环节的管理上也更松,比如在其供应链条各个环节可以拆分得很细,也就是可以由多个外包方来完成质量活动。我们分阶段给大家介绍,产品进入欧洲市场的一些管理特点。
今天,我们就来看一看,供应链环节的各分包商的合作及其职责规定(合同)可以采取什么形式进行管理?
首先,我们看一下法规。在今年7月,EMA新增发布了一条欧盟 GMP 问答——外包活动相关内容:关于多方分包协议如何采用合同链形式进行管理。在这篇问答中相关联了MAH、负责产品QP认证的MIA持有人以及多方的合同制造商之间的合同要求。本期德恩MAH专家钟老师对这条问答进行了梳理总结并与大家分享,希望对大家的工作有所帮助!
EMA新增的主要问题:是否要求MAH、负责QP认证的MIA持有人和参与各个阶段认证的工厂之间达成直接协议?
备注:
MAH (Marketing Authorization Holder)是指药品上市许可持有人(产品拥有者)
MIA (Manufacturer’s / Importation Authorisation),是指生产商/进口的证书(非欧盟境内生产或进口需欧盟境内公司具有的资质)。
EMA官方回答:
MAH和负责产品QP认证的MIA持有人之间应签订直接书面合同。
负责产品QP认证的MIA持有人与在产品进行认证前的生产、进口、试验、储存的各个阶段所涉及的工厂(以下简称合同制造商)之间也应签订直接书面合同。
当然,在多方之间有直接的书面合同也是可以接受的,例如MAH、负责产品QP认证的MIA持有人和合同制造商或包括在生产/供应链中的任何其他实体,只要每个实体的相关活动和责任都有明确的定义,也是可以多方之间进行直接的书面合同。

图1 各方之间的合同关系图例
另外,在本次问答中也有讲明,如果遵守以下9个原则,则可以例外地接受“合同链”的建立,则可以不用进行上述所述的负责产品QP认证的MIA持有人与各个涉及的合同制造商签订直接书面合同:
1. MAH, MIA持有人(QP)和合同制造商之间有紧密和及时的沟通。
2. MIA持有人(QP)有权访问合同链中的所有合同。
3. MIA持有人(QP)在对其适用性和功能方面进行书面评估后,以书面形式接受合同链的安排。
4. 任何的变更都应通知MIA持有人(QP),并在各自合同应在变更之前接受。
5. 供应链中的所有合同制造商都经过审核和评估。
6. “合同链”的建立应反映出EU GMP附录16:1.7.2中提到的供应链图中。
EU GMP附录16:1.7.2指出:
The entire supply chain of the active substance and medicinal product up to the stage of certification is documented and available for the QP. This should include the manufacturing sites of the starting materials and packaging materials for the medicinal product and any other materials deemed critical through a risk assessment of the manufacturing process. The document should preferably be in the format of a comprehensive diagram, where each party, including subcontractors of critical steps such as the sterilisation of components and equipment for aseptic processing, are included.
直到认证阶段的原料药和药品的整个供应链都有文件记录,并且QP可获得这些记录。这应包括药品起始原料和包装材料的生产场所,以及通过生产过程风险评估认为至关重要的任何其他材料。
该文件最好采用综合图表的格式,其中包括关键步骤的分包商,例如用于无菌处理的组件和设备的灭菌。
7. “合同链”的建立应作为产品质量回顾(PQR)过程的一部分进行审查。
8. MIA持有人(QP)拥有足够数量的具有必要资格和实践经验的人员(EU GMP第2章人员)来审查和评估记录和结果。
EU GMP 第二章节人员指出:
For medicinal products manufactured within the European , a Qualified Person must ensure that each batch has been manufactured and checked in compliance with the laws in force in that Member State and in accordance with the requirements of the marketing authorisation;
In the case of medicinal products coming from third countries, irrespective of whether the product has been manufactured in the European a Qualified Person must ensure that each production batch has undergone in a Member State a full qualitative analysis, a quantitative analysis of at least all the active substances and all the other tests or checks necessary to ensure the quality of medicinal products in accordance with the requirements of the marketing authorisation. The Qualified Person must certify in a register or equivalent document, as operations are carried out and before any release, that each production batch satisfies the provisions of Article 51. The persons responsible for these duties must meet the qualification requirements laid down in Article 493 of the same Directive, they shall be permanently and continuously at the disposal of the holder of the Manufacturing Authorisation to carry out their responsibilities.
The responsibilities of a QP may be delegated, but only to other QP.
对于在欧盟境内生产的药品,QP必须确保每个批次的生产和检查符合该成员国现行法律并符合上市许可的要求;
对于来自第三国的药品,无论产品是否在欧盟生产,QP必须确保每个生产批次都在成员国进行了至少所有活性物质的完整定性分析,定量分析和所有其他必要的试验或检查,以确保药品质量符合上市许可的要求。在操作进行时和放行前,QP必须在登记本或同等文件中证明每个生产批次符合第51条的规定。负责这些职责的人员必须符合同一指令第493条规定的资质要求,应永久和持续地由生产许可持有人处置,以履行其职责。
QP的职责可以授权,但只能授权给其他QP。
9. 确保与生产活动相关的记录在保存期间的完整性,并在持有MIA的地点得到保护。
因此,如果遵守以上9个原则,则可以建立“合同链”而不需要各方进行签订直接书面合同。图2展示的仅为其中一种方式,还有多种方式可以,整体要求为满足责任明确为核心。
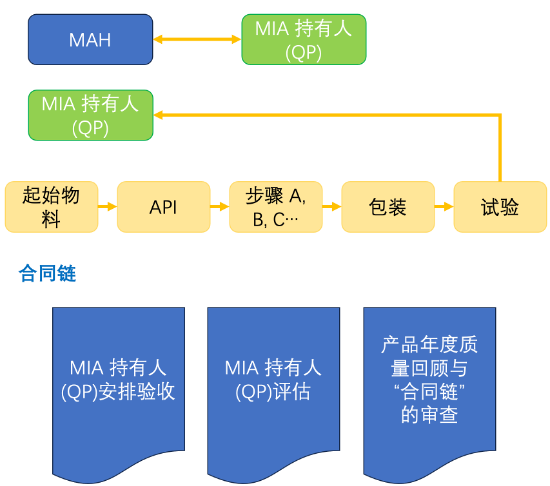
图2 各方之间可以采取的“合同链”关系
以上是本期EMA发布的MAH、MIA以及生产中各方工厂之间的2种合同关系。如您对此问有疑问,可在下方留言,专家将与您一起探讨。