#欧盟QP审计# #QP合规#
2025年10月,翰森制药、普耀金生物与维立志博接连达成重磅海外授权, ADC、细胞基因治疗等前沿领域交总额突破十亿美元,彰显中国药企的国际化步伐正在加快。
而欧盟作为全球重要的医药市场,成为众多企业瞄准的关键目标。然而,欧盟质量受权人(Qualified Person, QP)制度作为市场准入的法定门槛,却因法规复杂严格成为众多中国药企的出海“拦路虎”。
gempex德恩咨询基于丰富的实战经验,为中国药企提供欧盟QP审计通关指南。
欧盟QP审计:
中国药企进入欧盟市场必答题
欧盟QP制度依托2001/83/EC、Regulation 536/2014等法规构建,其核心在于:
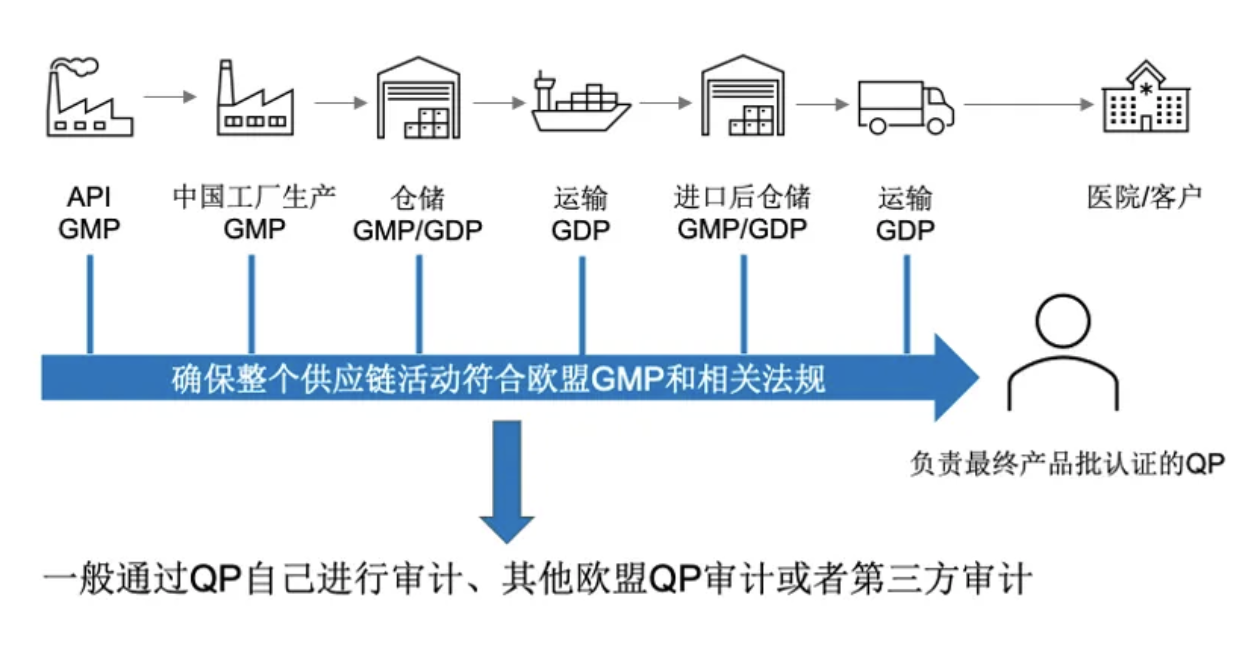
图1 欧盟QP四大维度
图2 欧盟QP审计的全供应链
面对QP审计这道必答题,中国药企只有提前规划、系统准备,才能将合规要求转化为市场竞争优势,在全球化浪潮中赢得先机。
哪些企业
需要 QP审计?
在行业发展背景下,以下企业是建议尽早考虑开展QP审计:
从临床试验到上市销售,全生命周期均需QP认证。在临床试验申请阶段,所有试验用药品都必须获得QP的符合性确认;在上市申请阶段,则需要完成商业化生产基地的全面QP审计;即使在产品上市后,涉及生产工艺的重大变更时仍需重新接受QP审计。
CDMO/CMO企业需要通过QP审计向全球客户证明其质量管理体系符合国际标准,审计范围涵盖从物料管理到产品放行的所有环节,同时需要建立持续合规机制以应对QP定期进行的再审计。
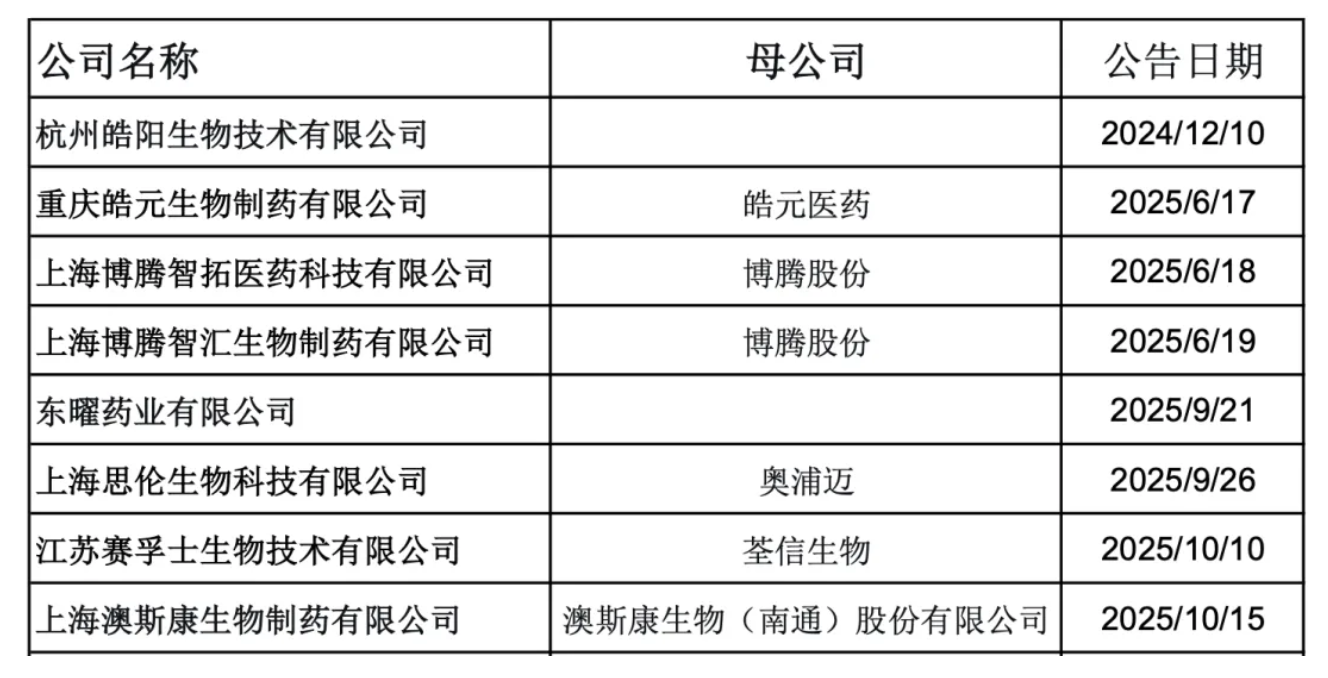
行业观察显示,仅在过去一年中,已有多家本土CDMO企业(如皓阳生物、博腾制药、东曜药业等)相继公告其生产线或质量体系成功通过QP审计,这充分体现了中国CDMO/CMO行业为提升国际竞争力而对合规建设的高度重视。德恩咨询也为其中部分企业提供了QP审计支持。
原料药生产企业虽然不直接面对终端市场,但作为药品制造的起始点,同样需要满足QP审计的严格要求。审计重点包括工艺验证的充分性、交叉污染防控措施的有效性等核心要素,确保其产品质量和供应链透明度能够满足欧盟市场要求。
这些情况必须通过QP审计:
4大审计场景详解
依据EU GMP Annex 16,QP共承担多达21项职责,并需依托持续可靠的质量体系作为履职基础。这意味着,QP必须通过审计等方式,确认所依赖的质量体系处于有效运行状态。

图3 持续可靠的质量体系
德恩咨询根据多年项目经验,总结出中国药企最常触发的4类审计场景:
在企业计划进入欧洲市场前期,主动邀请欧盟QP及其团队对GMP体系和硬件设施进行全面的现场审核。审核重点在于识别EU GMP的潜在差距,进一步提升质量体系。本阶段获取的EU QP证书可为企业未来提供更多进入欧洲市场的可能性。
在申报欧洲的临床试验前,企业需要自建机构或寻找合作欧盟代理机构,并接受其注册QP的审计。审核聚焦于拟申报产品的具体工艺和质控细节,获取的QP证书(QPD)是申报CTA的必备资料之一。
在欧盟QP进行第一次批认证前,需要评估以往的审计报告是否能支持其作出批认证的决定。若以往的审计不是该QP自己或不是其信赖的团队进行,该QP往往会主动发起审计。在审计通过后,其才会做出批认证的决定。审核重点聚焦于更细致的工艺细节以及涉及的偏差/变更,可能需要在现场进行批记录的审核。
产品上市后,QP将根据剂型风险设定审计频率,通常为每年至每三年一次。
QP审计实战指南
4步通关,从准备到获证
QP 审计通常遵循 “四步流程”,企业应针对性做好准备:
1.准备阶段
QP 团队(一般由QP本人确定)以及可能包括技术专家等多学科人员,明确审计范围(如 制剂生产、仓储、实验室等),企业需提前整理英文版质量手册、批记录、偏差报告等资料;
2.现场检查
QP团队实地核查硬件设施(如洁净区、设备维护)、人员操作(如取样流程),重点关注 “数据完整性”(如电子数据审计追踪);
3.文件记录审核
对批记录与实际操作的一致性、变更控制的合规性、CCS(污染控制策略)的完整性;
4.后续跟进
审计发现项分“重大(需立即整改)、主要(限期整改)、微小(持续优化)、建议(参考改进)”四级,企业需要针对不同等级的发现项采取相应的纠正措施。
实战建议
避开常见合规陷阱
基于协助数十个药企成功通过 QP 审计的经验,德恩咨询建议企业从 “法规对齐、资料准备、风险规避”三方面着手,规避常见误区:
若企业未接受过欧盟 GMP 正式检查,建议先找专业的咨询公司开展 “全面差距分析”。对照 EU GMP 及相关附录等法规,系统比对质量体系与欧盟法规的差异。
主要质量管理文件(如 SOP、质量手册)、批记录需为英文,且符合欧盟 “可追溯” 要求。进口样品管理需要注意,如在欧盟境内进行批认证检验的样品在第三国取样,需有相应规程保证样品符合要求(如取样人员资质、样品封装标识)。
德恩咨询总结 QP 审计过程中国药企常见问题,需重点关注:
①污染控制策略(CCS):需明确 “污染源识别 - 控制措施 - 监控方法”,避免遗漏 “污染防控” 细节;
欧盟 QP 制度与审计是企业进入欧盟市场的 “必答题”,而非 “附加题”。德恩咨询深耕欧盟 GMP 合规 23年,可提供从 “QP 制度解读”到 “审计准备和整改支持”的全流程服务 —— 无论是配备合规QP资源,还是陪同应对现场审计,我们均能以本土化经验与专业服务,助力企业降低合规成本,加速欧盟市场准入进程。
德恩咨询的QP检查服务包含但不限于:
我们拥有不同领域的高级EU QP顾问,如:生物制剂、无菌产品、口服固体产品、ADC(抗体偶联产品)、ATMP(先进疗法产品)、CGT(细胞治疗及基因治疗产品)、血液制品、高活产品、及原料药等等,支持企业国际市场的拓展。

欢迎垂询
服务热线:400-166-2002
邮箱:info-cn@gempex.com
关于gempex德恩咨询
德恩咨询是gempex在中国的全资子公司,是具有国际影响力的GMP咨询与执行机构,致力于为全球的生命科学企业提供合规、高效及可执行的GMP解决方案。经过23年的发展,我们拥有60多位经验丰富的GMP专家,全球累计执行项目超过5000个,累计为1000多个客户提供专业服务,业务遍布20多个国家,并与众多知名药企建立了长期的合作关系。
我们的专家团队拥有丰富的行业经验,熟知NMPA、FDA、EU、WHO、ICH、PIC/S、MHRA、SWISSMEDIC、TGA等GMP法规要求,能为不同国家和地区的客户提供定制化的解决方案,服务包括全球GMP符合性、新厂房合规性、CS计算机化系统、工厂质量管理和多国MAH/MAA服务。