
近日,ICH正式发布了新的《ICH Q1稳定性试验指南》(草案),全文共计108页。该版ICH Q1 稳定性研究指南草案整合了化药、生物药等多种产品类型,覆盖产品全生命周期,优化了研究设计与数据评估,更好地适配现代疗法,并提升了全球监管协调性。
以下是德恩咨询专家团队对本版草案要点的梳理与解读,供行业同仁参考。

-
将原有ICH QI A-F 和 Q5C 进行全面修订并整合,形成统一的ICH Q1指南;
-
旨在解决潜在差距、歧义和解读碎片化问题;
-
整合现代工具、先进疗法和生命周期稳定性;
-
提升监管协调性和清晰度。




 根本性变革
根本性变革
整合了化学药和生物药(包括先进治疗药品)的稳定性要求,结束了以往分散在多份指南中的局面。
 广泛适用性
广泛适用性
-
产品类型:化学合成实体(包括多肽、多糖)、生物制品(治疗性蛋白、血浆制品、ADC)、疫苗、基因和细胞治疗产品(ATMP)、药械组合、天然药品等。
-
申报类型:新药、仿制药、生物类似药、新剂型、批准后变更。
-
生命周期覆盖:从首次注册到产品终止的全生命周期。
 不适用范围
不适用范围
医疗器械部分、放射性药品、全血制品。

指南明确了两种主要研究类型:
 正式稳定性研究
正式稳定性研究
-
目的:建立或确认复检期(原料药)或有效期(制剂)。
-
类型:注册研究、承诺研究、持续(年度)研究、产品生命周期研究(支持变更)。
 支持性稳定性研究
支持性稳定性研究
-
目的:支持产品在实际使用中的稳定性。
-
类型:光稳定性、使用中稳定性、短期贮存条件研究、运输研究、影响因素/强制降解研究(开发阶段)。

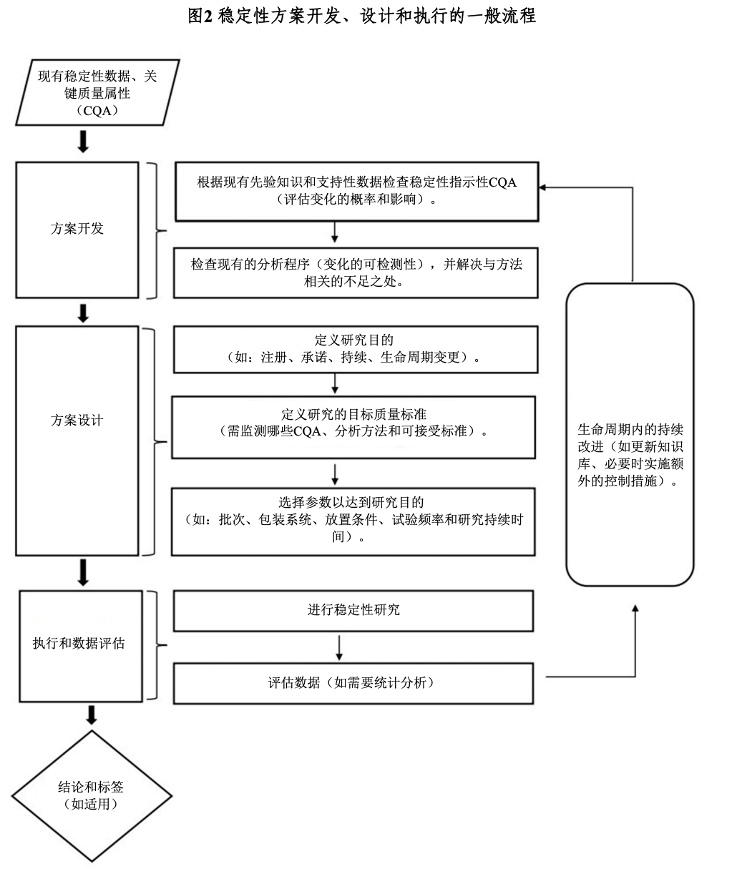
 方案设计一般原则
方案设计一般原则
-
基础:基于对关键质量属性的理解,识别哪些CQA在贮藏期间易发生变化并影响安全有效性。
-
标准方法:首次申报时,需提供至少3个批次在长期条件和加速条件下的稳定性数据。
-
简化设计:允许使用括号法和矩阵法,以减少测试负担,但需进行科学论证和风险评估。
-
质量标准:放行标准与有效期标准可以不同,后者通常更宽,但任何差异需有数据支持;稳定性指示分析方法必须经过验证,能够检测出产品的变化。
 批次选择
批次选择
-
基本要求:通常需要3个批次。
-
批次规模:化学药:至少中试规模(通常为生产规模的1/10或10万单位,取较大者);生物药/疫苗:鼓励使用生产规模批次。若使用非生产规模批次,需提供论证,并承诺继续进行研究。
-
代表性:批次应能代表生产工艺和质量,原料药批次应不同以涵盖变异。
 容器密封系统
容器密封系统
-
研究必须使用拟上市包装或具有代表性的包装。
-
需评估包装与产品的相容性,特别是对于液体制剂,可能需评估不同放置方向(如倒置、直立)的影响。
-
明确区分:非渗透性容器(如玻璃安瓿、铝管):湿度不是问题,可在任何湿度下研究;半渗透性容器(如LDPE袋、瓶):必须评估水分损失,并在低湿度条件下进行研究(如25°C/40% RH)。
 检测频率
检测频率
-
长期研究(有效期>12个月):建议0, 3, 6, 9, 12, 18, 24, 36个月...此后每年一次。
-
加速研究(6个月):至少0, 3, 6个月三个时间点。
-
可根据产品知识和风险评估,在生命周期中调整(减少)检测频率。
 贮藏条件
贮藏条件
指南根据气候带和贮藏温度提供了详细的贮藏条件表,以下是核心总结:


 光稳定性
光稳定性
-
决策树:系统光稳定性试验的决策流程图与之前保持一致,没有更改。
-
两种研究:强制光降解:开发阶段进行,用于了解降解途径和方法开发;确认光稳定性研究:确认研究用于确定在生产、产品剂型、长期贮藏或使用期间是否需要采取特殊预防措施,以及是否需要避光容器密封系统和/或特殊说明书及标签信息。为确定是否应进行确认研究、研究设计和结果分析提供了指导。
 使用中稳定性
使用中稳定性
-
目的:确定多剂量制剂或需配制制剂在首次开启/配制后的使用期限。
-
研究设计:模拟最差使用条件(如反复穿刺抽取、稀释后贮存)。
-
批次:通常2个批次,至少1个批次应接近有效期。
-
测试属性:除理化属性外,必须包括微生物测试(如防腐剂有效性)或无菌保证(如容器密封完整性)。
 中间产品稳定性
中间产品稳定性
-
区分加工时间(连续生产步骤)和保持时限(包装后等待下一步)。
-
对于包装贮存的中间产品,可建立复检期/有效期;对于工艺过程中的中间产品,应建立保持时限,并考虑理化与微生物两方面的稳定性。

这是指南的技术核心部分,引入了更灵活的统计和外推方法。
 统计分析:对定量CQA(如含量、杂质)的数据,应使用统计方法(如线性回归、ANCOVA)进行分析,确定95%置信限与质量标准相交的时间点。
统计分析:对定量CQA(如含量、杂质)的数据,应使用统计方法(如线性回归、ANCOVA)进行分析,确定95%置信限与质量标准相交的时间点。
 外推法
外推法:
-
化学药(决策树):允许在长期数据基础上外推以设定更长的有效期。
-
场景A(最佳):长期和加速数据均显示很小或没有变化/变异。可外推至2倍长期数据时间,但不超过X+12个月(室温)。
-
其他场景根据数据质量和是否有显著变化,允许不同程度的外推(如1.5倍或X+6个月)。
-
生物药:原则上有效期基于实时数据。但对于充分表征、冷冻保存的原液,在严格条件下可考虑有限外推(最多1.5倍或X+12个月)。制剂外推风险高,需提前与监管机构沟通。
 稳定性建模
稳定性建模(附录2):鼓励使用增强的稳定性模型(如基于Arrhenius方程),利用加速数据和先验知识来预测长期稳定性,可作为综合稳定性策略的一部分。

 承诺稳定性研究
承诺稳定性研究
若注册申报数据未覆盖拟定的全部有效期,需承诺在批准后继续进行研究。
 持续稳定性研究
持续稳定性研究
每年至少一批,用于监控商业化产品的稳定性趋势,确认有效期。
 批准后变更:采用基于风险的方法。
批准后变更:采用基于风险的方法。
-
场景1:变更不影响稳定性(如分析方法的微小变更)→ 无需稳定性数据。
-
场景2:变更可能影响稳定性(如生产工艺、处方变更)→ 需进行稳定性研究,可能需要重新设定有效期。

 附录1
附录1
详细说明了括号法(只测试极端因素水平)和矩阵法(在不同时间点测试不同因素组合的子集)的设计原理、示例和风险。
 附录2
附录2
深入阐述了稳定性建模的开发、验证和确认原则,支持使用更复杂的统计和预测工具。包括未来也可能会出现新的模型类型(例如,使用人工智能机器学习,AI-ML)。
 附录3
附录3
针对先进治疗药品(ATMP)的特殊指导,强调实时数据的重要性、功能性CQA(如细胞活力、病毒滴度)的监测,以及在小批量、个性化生产背景下灵活运用简化设计和风险评估。

-
提升全球协调性,加快监管审批。
-
支持创新疗法和基于平台的申报。
-
通过可靠的稳定性数据,实现高效的产品生命周期管理。
-
提供培训材料和案例研究,以支持第四步之后的实施。
此次ICH Q1指南的更新,是近二十年来稳定性研究领域最为全面和深刻的一次变革。它为企业优化研发路径、提升生命周期管理效率提供了清晰的框架,同时也对企业在稳定性研究的设计、数据分析及统计建模等方面提出了更严谨的要求。
德恩咨询作为深耕GMP合规领域23年的专业服务机构,在药品分析检验、稳定性研究设计与数据评估、统计学应用等方面拥有深厚的技术积累与项目实践经验。我们可为企业提供从稳定性及稳定性数据评估支持,助力企业精准应对新规挑战,实现稳健合规与产品价值最大化。
关于德恩咨询
gempex德恩咨询深耕GMP合规领域23年,致力于为全球的生命科学企业提供合规、高效及可执行的GMP解决方案,帮助制药、生物技术、原料药、化学、医疗器械、原辅包和化妆品等各方达到GMP标准,减少合规及药品安全风险。
目前,我们拥有60多位经验丰富的GMP专家,全球累计执行项目超过5000个,累计为1000多个客户提供专业服务,业务遍布20多个国家,并与众多知名药企建立了长期的合作关系。
服务热线:400 166 2002
邮箱:info-cn@gempex.com


统计分析:对定量CQA(如含量、杂质)的数据,应使用统计方法(如线性回归、ANCOVA)进行分析,确定95%置信限与质量标准相交的时间点。
承诺稳定性研究
持续稳定性研究
批准后变更:采用基于风险的方法。
附录1
附录2
附录3