#WHO #WHO预认证 #PQ #GMP认证
导读
我们都比较熟悉WHO(World Health Organization)世界卫生组织(简称世卫组织),特别是在制药行业,你可能听说过WHO认证或者WHO PQ(Prequalification)预认证或者公司内部正计划开展此类工作,但可能不太清楚该从何着手。今天就让我们来给大家简单聊一聊WHO PQ预认证是什么,具体依照的流程以及收费情况供参阅。
01 WHO PQ药品预认证由来?
世卫组织的药品的预认证成立于2001年,最初是为了应对艾滋病HIV/AIDS流行病,提高向低收入国家供应药物的质量。继世卫预认证工作取得成功后,其范围即开始逐步扩大,涵盖其他治疗领域产品。最近,随着全球技术和产品的发展,世卫也开展了治疗癌症的生物治疗药物和治疗糖尿病的胰岛素的试点工作,开创了药物评估和检查专业知识的新领域。预计药品预认证将进一步扩大到用于治疗其他非传染性疾病的产品,无论是化学产品还是生物治疗产品。
02 WHO PQ的具体工作有哪些?
预认证的工作范围涵盖:制剂(FPP)、原料药/活性药物成分(API)和检验实验室(QCL)。世卫组织预认证的目的是确保原料药和制剂产品的安全、适当并符合质量标准。
认证的主要的活动涵盖:
制剂产品档案或原料药主文件的评估;
检查药品生产和临床试验场所;
组织检验产品
这些活动是世卫组织评估议程的一部分,旨在最大程度增加获得有质量保证的药品的机会。除药品外,世卫组织的预认证范围涵盖免疫接种设备、体外诊断试剂、疫苗和病媒控制产品。
符合评估和检查标准的原料药被添加到WHO活性药物成分预认证清单中;将符合评估和检查标准的制剂添加到WHO预认证药品清单中。
世卫组织还对实验室进行资格预认证,特别是对药品进行化学和微生物检测的实验室。分析活动符合世卫组织推荐标准的实验室将被添加到世卫组织质量控制实验室预认证名单中。我们常常知道预认证是涵盖药品的,但可能忽略了实验室也是可以的,对于提供第三方检验服务的公司,也是以考虑这部分以提高自身的一些资质认可度。
03 WHO PQ的流程是什么?
对于具体的认证流程和费用,世卫组织根据产品类型:药品、免疫接种设备、体外诊断试剂、疫苗和病媒控制产品进行了分门别类的阐述。这里我们以药品(Medicines)来进行举例说明。
药品模块预认证的对象:
首先,任何活性药物成分(API)和/或制剂(FPPs)的生产商,如其产品符合条件且有意愿接受世卫组织评估,均可以提交申请。制剂可以是仿制药和创新药以及含有一个活性成分或多个活性成分的制剂均可。负责药品化学和微生物(包括细菌内毒素)检测的实验室也有资格申请。
药品模块预认证的流程:
制剂和原料药大流程如下:
生产制造商确认其希望提交用于资格预认证的原料药或制剂包含在相关的“邀请生产制造商提交评估意向书”(EOI)中,具体可查阅:https://extranet.who.int/pqweb/medicines/products-eligible-prequalification
生产制造商根据预认证流程为其意向产品向WHO提交申请;
世卫组织查阅内部的筛选清单,对提交评估的信息进行筛选以进行资格预审;内部核查档案清单,是在分配世卫组织参考编号前确认其产品符合要求并确认是否接受全面评估。该清单提供了哪些方面被认为是评估的关键要素,核查过程可能会需要生产制造商提供额外信息;
若递交申请的产品已经在更高标准的法规市场批准了,那么申请人可以选择递交简略评估申请;
对产品档案及生产商(原料药及制剂)以及临床试验地(比如CRO)的WHO的相关规范的符合性进行评估,如现场检查。
对于实验室的预认证与上述流程相似,包含以下步骤:
QC实验室与相关部门咨询其是否属于预认证范围;
QC实验室根据流程递交申请,需包含实验室的信息;
WHO审核实验室信息(或者质量手册)。在过程中可能会要求提供额外的信息以及可能会引发对实验室的检查;
当实验室符合预认证的要求后会增加到通过认证的清单中。
当通过预认证后,产品将列入WHO的网站,查阅地址如下:
https://extranet.who.int/pqweb/medicines/prequalified-lists
04 WHO PQ的收费情况如何?
费用与预认证的类型相关,也与其评估的类型,比如是完整的评估还是简略程序的评估有关。此外,就是年度的维护费用以及发生变更的时候产生的费用。
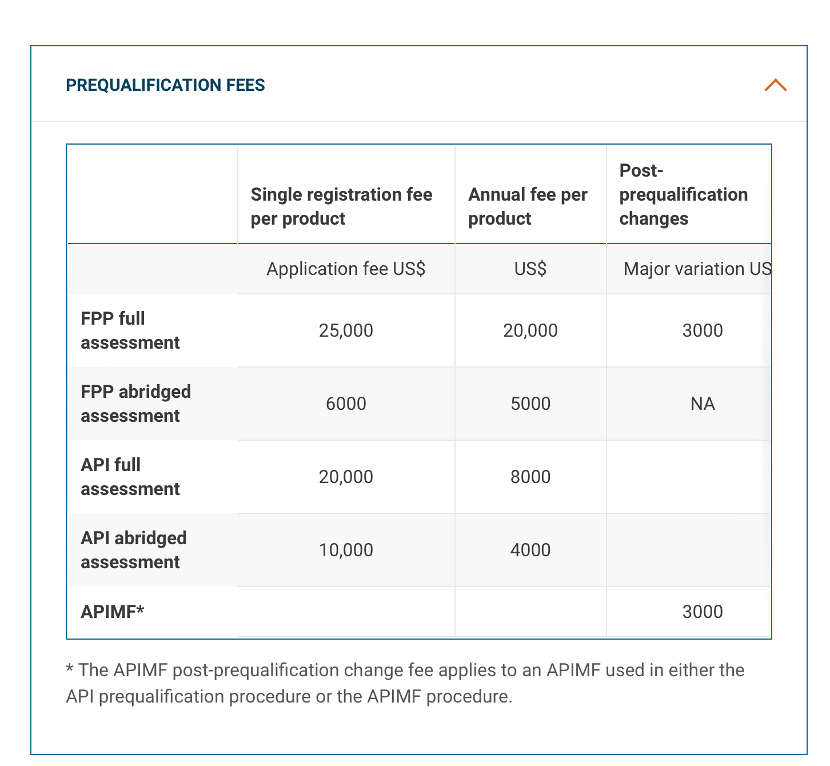
图1 WHO预认证费用
以上对于WHO PQ的一些基本情况,给大家做了一些简介,信息来源均是WHO官方信息,具体可以查阅:https://extranet.who.int/pqweb/medicines
对于以上流程,我们也截取WHO Technical Report Series, No. 961, Procedure for prequalification of pharmaceutical products (2011) 的附录1做一个整体总结:
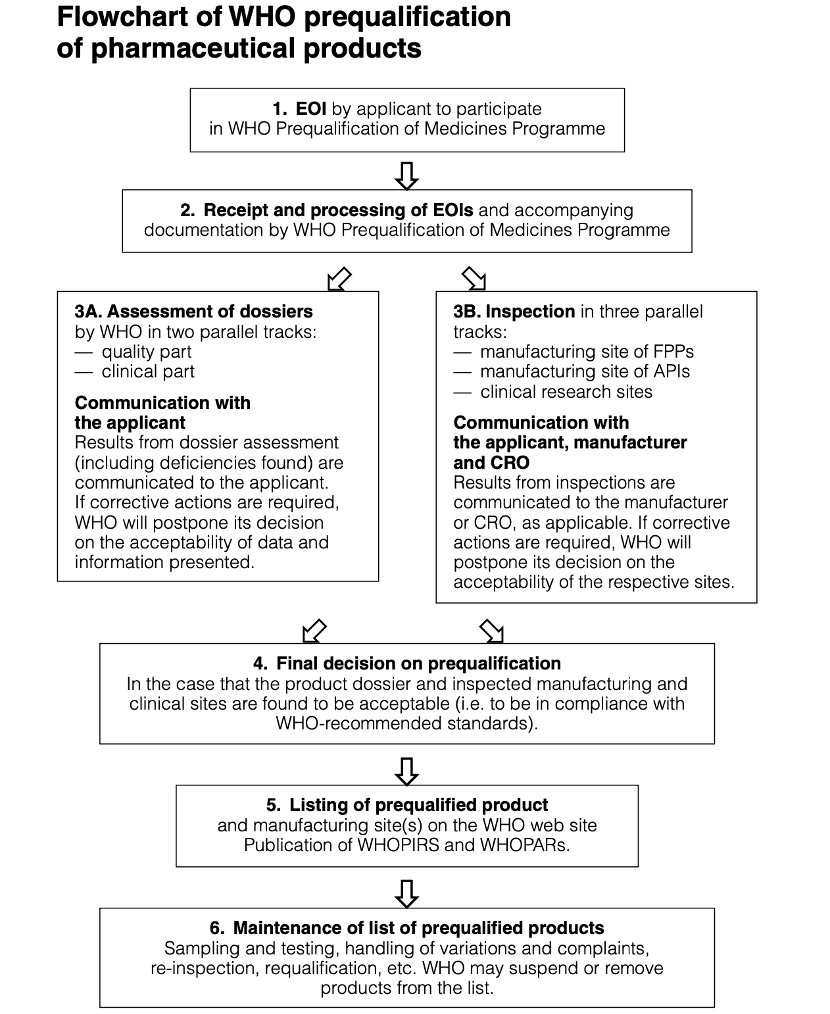
图2 WHO药品预认证流程图
05 WHO PQ的时限情况如何?
关于时限,可能也是大家比较关心的一个点,从已经通过预认证并能查阅到的信息来看,如果已被更高标准法规市场(如欧美)批准的产品显然会快速很多,对于没有通过一些高端市场的批准的产品以及首次预认证的会相对慢很多,且相互交互过程包括多次提供相关信息的情况。比如:罗氏的一个产品RoActemra,2021年11月递交档案,2022年2月加入预认证清单,当然前提是该产品是在通过检查并EU上市的产品,因此时间是相当快速的。另外举例一个国产的口服固体制剂,从2015年递交到最终列入批准清单经历了三年多的时间,中间有多次的信息补充递交要求以及回复,时间还是跨度较大的。因此,我们如果有计划进行WHO PQ预认证,充分的准备以减少过程时间,对于抢占市场先机来说就显得很重要。
参考资料:
以上信息来自于WHO官网:https://extranet.who.int/pqweb/medicines