#欧盟检查 #GMP检查
导读
随着国内医药行业的不断发展,越来越多药企将药品出口到国际市场。而对于进口到欧洲国家的药品,欧洲药品管理局EMA必须保证这些药品都是需要在符合欧洲现行药品生产质量管理规范下生产的。因此,中国企业的原料药、仿制药或者新药想进入欧洲国际市场,需要通过EU的GMP合规性检查,确认符合欧洲的法规要求,才能获得药品的注册和/或GMP的证书。反过来说,国内企业通过了解欧盟GMP检查的要求,进行计划、准备以及迎接检查时恰当地应对,对企业能否顺利地通过欧盟GMP检查具有重要意义。
药品进入欧洲市场,可以选择不同的方式,如集中审评或单一国申请等。在药品GMP方面,如果拟通过集中审评获得上市许可,将主要由EMA统筹协调相关的检查标准,实际检查活动可能由各欧盟成员国的监管部门安排具备资质的检查员负责执行。欧盟各成员国的GMP检查的要求及流程虽不尽相同,但其重点及关键要求基本相通。
01 欧盟GMP检查的整体考虑
EMA发布的
首要责任是根据欧盟规定保护公众健康;
确保制药企业遵守GMP指南要求;
确定质量保证体系中的各个要素对于实现GMP合规有效且适当。
反过来说,以上方面也是企业通过欧盟GMP检查所需优先考虑的要素。接下来,我们将通过介绍欧盟GMP检查流程来分享企业应注意的事项。
02 欧盟GMP检查的流程
1. 检查准备
在进行正式的GMP检查前,相关监管部门会在根据“基于风险的制药企业检查计划模型”对具体企业事先制定检查计划。
然后检查员一般会通过以下文件[1],熟悉受检企业的具体情况:
目标工厂的SMF
上次检查报告以及相关整改情况
目标产品的上市注册许可文件以及相关变更情况
监管数据库信息(EudraGMDP,FDA警告信)
上次检查后执行产品召回情况
上次检查后通报的产品缺陷情况
上次检查后由OMCL(官方药品检验所) 执行的样品分析情况
设备、工艺和关键人员的重大变化
目标产品上市注册许可的关联部分的情况
上市注册许可的变更申请、批准和拒绝的情况
因此,在接受欧盟的GMP检查前,企业可以提前准备好相关的材料,并做好充足的准备。
2. 现场检查
应当注意监管部门有权执行飞行检查,也可能会提前告知企业检查行程,比如检查的日期/天数、检查范围等,让企业了解检查的目的,以便于更好的准备相关人员和文件。
具体的现场检查流程可以整理为:
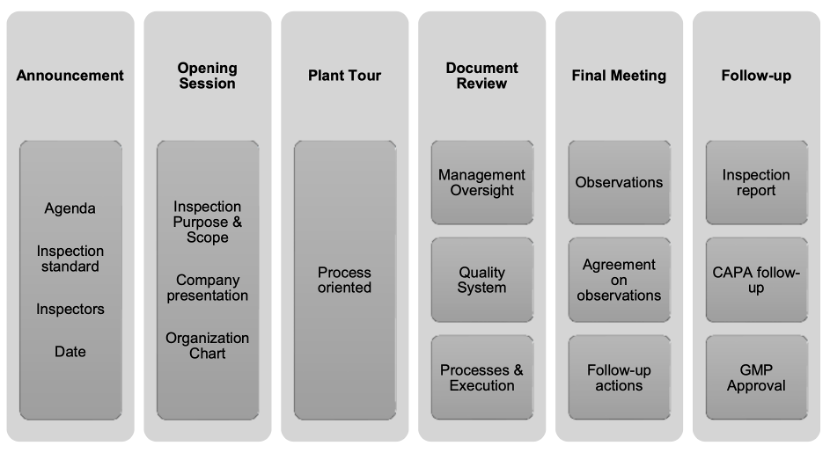
图1 现场检查流程图
那么,企业可在对应的流程环节中提前安排好相关人员来负责现场接洽引导和回答检查员的问题。
03 欧盟GMP检查的注意事项
我们了解完GMP检查的整个流程,在整个过程我们还需要注意以下事项:
1. 问题回答
基于事实,清晰回应
如若回答出现错误,当即改正
注意克制,问哪里答哪里
问题发出后,安排一人回答,不要多人同时回答
答完确认一下检查员是否理解了回应的内容
2. 文件
注重文件实据,并且及时提供文件
尽可能避免让检查员催促多次要同一个文件
还有一些是检查员比较共同的期望,也应当注意:
不要拒绝检查员要求进入检查相关区域的要求
如果检查中发现一些明显的事实/缺陷,不要尝试去掩盖
迎检时,不要尝试对文件、房间和设备做紧急/临时修改
03 德恩案例
那么,德恩在此与大家分享模拟检查的一个案例,以便大家对模拟检查具有更深入的了解。
国内某疫苗龙头企业
对两条有代表性的疫苗原液生产线和一条有代表性的制剂线,及其相关配套设施,进行一次模拟检查,评估其质量管理体系是否满足欧盟GMP管理要求;
四天的模拟检查,由德恩EU前检察官和经EU前检察官培训的中国专家一起执行;
提供涵盖发现项的报告并提供整改建议;
审核CAPA清单以优化其欧盟GMP符合性。
该公司目前已成功通过了欧盟的QP检查,这意味着EU GMP符合性的确认。
04 德恩专家
在GMP检查方面,德恩不仅仅实战经验丰富,人员方面也具有丰富的GMP咨询经验,如下:

Dr. Martin Melzer
前 EU 检察官
公共健康药剂师
GMP高级顾问

Mr. Eric Zhong
GMP专家
执业药师
国际审计员
参考资料
[1] EMA
以上是本期欧盟GMP检查的分享,如您对本文章有疑问,可发送信息到info-cn@gempex.com与我们联系,我们的技术专家将与您一起探讨相关问题。