#MAH体系
导读
在上一篇德小恩主要讲述了MAH的历史以及主要国家的MAH对比。本期将继续带大家往下深究MAH,主要分享MAH的职责,它的体系是如何划分的,以及MAH的外包活动和监管三方面的内容。
01 MAH的职责
MAH对药品的生命周期所有活动负责。在《药品管理法(2019年版)》中明确指出,MAH的职责是主要负责药品全生命周期的质量安全,应全程监督药品生产过程,且负责产品最终向市场的放行。受托方只需负责对经其操作后的半成品或产品等做出相应的出厂放行决定[1],最终放行的责任由MAH承担,且不得将最终放行责任委托给受托方。MAH如何监管受托方的活动合规性,显得尤为重要。
1. 生产许可证的类型
MAH制度下,药品生产许可证有如下类型,分别为:
A证:自行生产药品的上市许可持有人
(类似传统模式下的生产企业)
B证:委托生产药品的上市许可持有人
(新模式下的MAH)
C证:委托的生产企业
(无论是否取得A证,委托生产时必须取得C证)
D证:原料药生产企业
持有人代理人
Tips:这里提一下对于境外持有人境内代理人的资质要求:
在中国境内设立的企业法人;
具有与从事代理工作相适应的质量管理制度,以及与其承担责任相适应的质量管理体系;
具有与从事代理工作相适应的办公场所、通讯方式、联系电话;
具有能够确保产品可追溯的管理系统。
2. MAH主体责任
质量协议:在质量协议签订前,需要对受托方进行全面考察,确认是否具有生产条件能力及符合GMP生产质量要求,包含比如:原辅料、包材、研发、生产、检验、储存等全面过程
确认、审计、日常监督:对受托方比如定期进行质量管理体系符合性审核;通过驻场QA提供帮助或支持或日常监督
技术质量沟通:MAH与受托方的一个沟通(比如关联审评审批、技术资料等);以及MAH与监管部门的沟通(比如审批资料、检查、变更等)
报告(包含药品年度报告、药品短缺报告、产品年度质量回顾、药物警戒相关报告等)
投诉/不良反应&召回
持续改进(变更):变更责任人-MAH
02 MAH体系的范畴
1. MAH关键体系范畴
从上述我们可以看出MAH是贯穿于药品的生命周期。它的体系管理根据公司业务阶段可以划分成不同阶段,其管理重点也有一些差异,可划分为三个阶段分别是:研发型体系、临床+生产体系、完整MAH体系,如下:
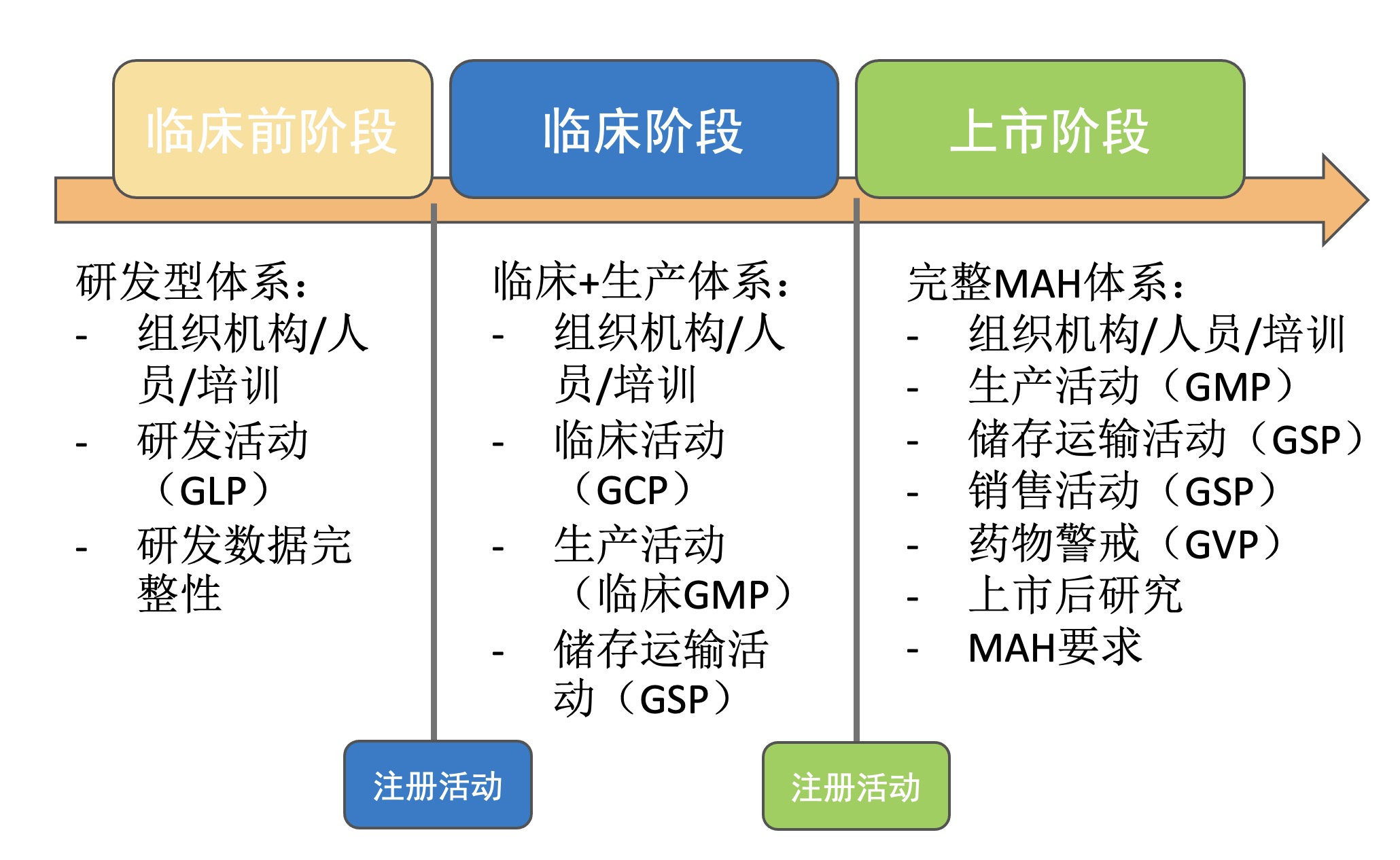
图1 MAH体系的关键阶段
那么,MAH的体系与传统的生产企业的体系又有何区别呢?
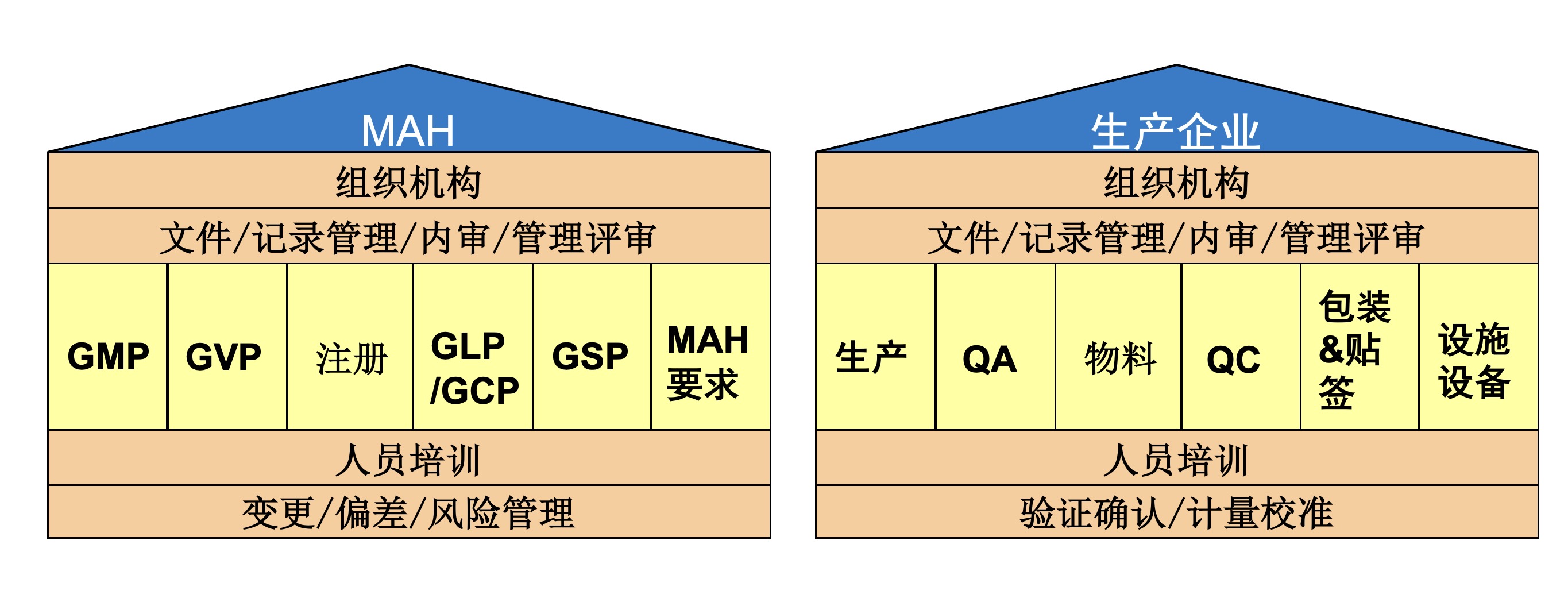
图2 MAH体系与传统生产企业的异同1
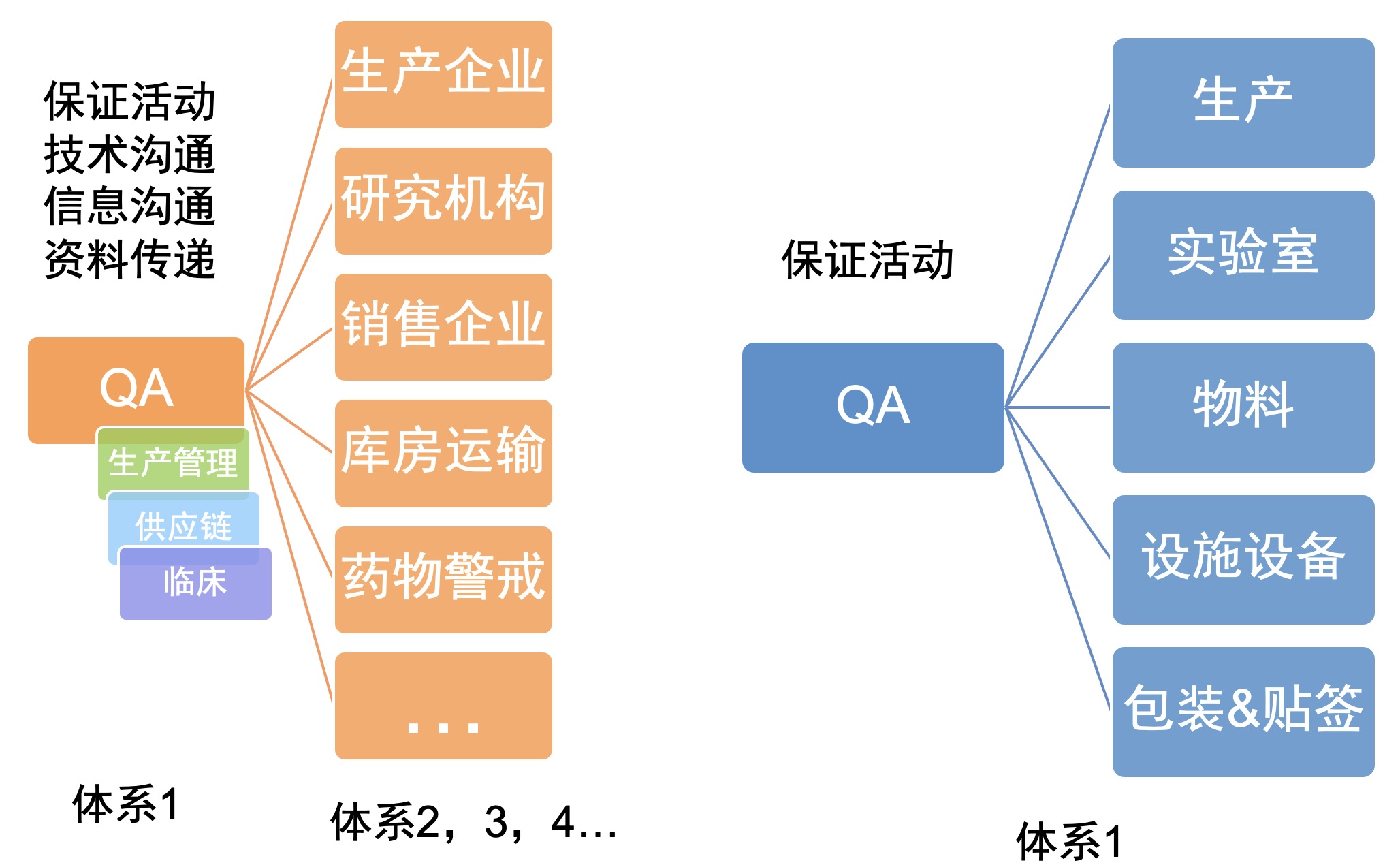
图3 MAH体系与传统生产企业的异同2
2. MAH体系的相关法规要求
由于相关法规较多,我们在这只列出国内相关的法规。
① 综合性政策法规
药品管理法(2019)
疫苗管理法(2019)
药品管理法实施条例(2022修订草案征求意见稿)
药品上市许可持有人检查要点(2022征求意见稿)
② 生产&质量相关
药品生产监督管理办法(2020)
药品生产质量管理规范GMP(2010)
药品GMP附录:临床试验用药品(2022试行)
药品委托生产质量协议指南(2020)
药品共线生产质量管理指南(2021征求意见稿)
药品检查管理办法(2021试行)
③ 注册相关
药品注册管理办法(2020)
④ 临床相关
药物临床试验质量管理规范(2020)
药物临床试验期间方案变更技术指导原则(2022试行)
⑤ 上市后管理
药品上市后变更管理办法(2021试行)
已上市化学药品/中药/生物制品 药学变更指导原则(2021试行)
已上市化学药品和生物制品临床变更技术指导原则(2022试行)
药品召回管理办法(2021征求意见稿)
药物警戒质量管理规范(2021)
药物警戒体系主文件撰写指南(2022)
药物警戒委托协议撰写指导原则(2020试行)
境外药品上市许可持有人境内代理人管理暂行规定(2020试行的征求意见稿)
3. MAH的外包活动和监管
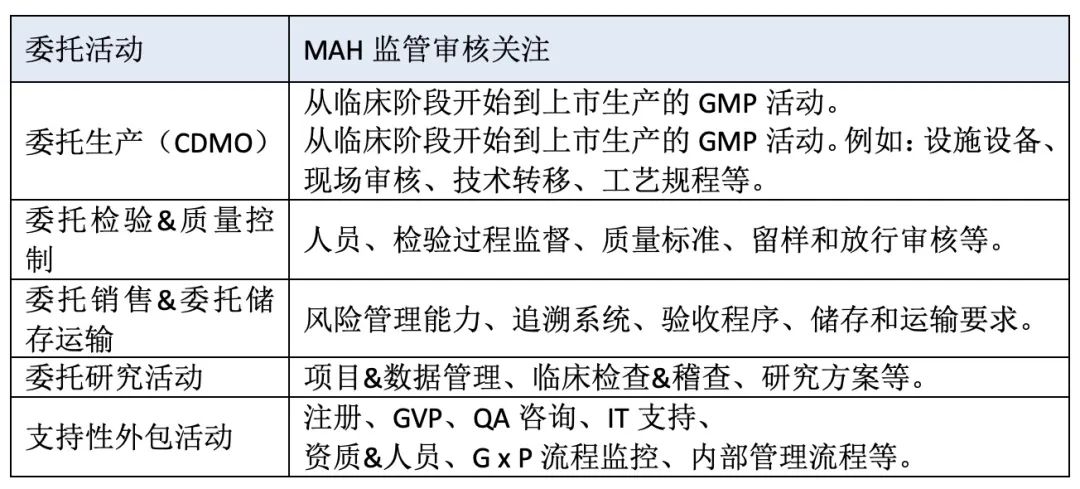
MAH的职责范围这么广,那么,全部一定得持有人自己做吗?不,很多版块也是可以委托外包的。如下图,我们可以清晰看出药品的生命周期中,持有人可在每个阶段分别可将一些相对应的工作外包给第三方公司执行。
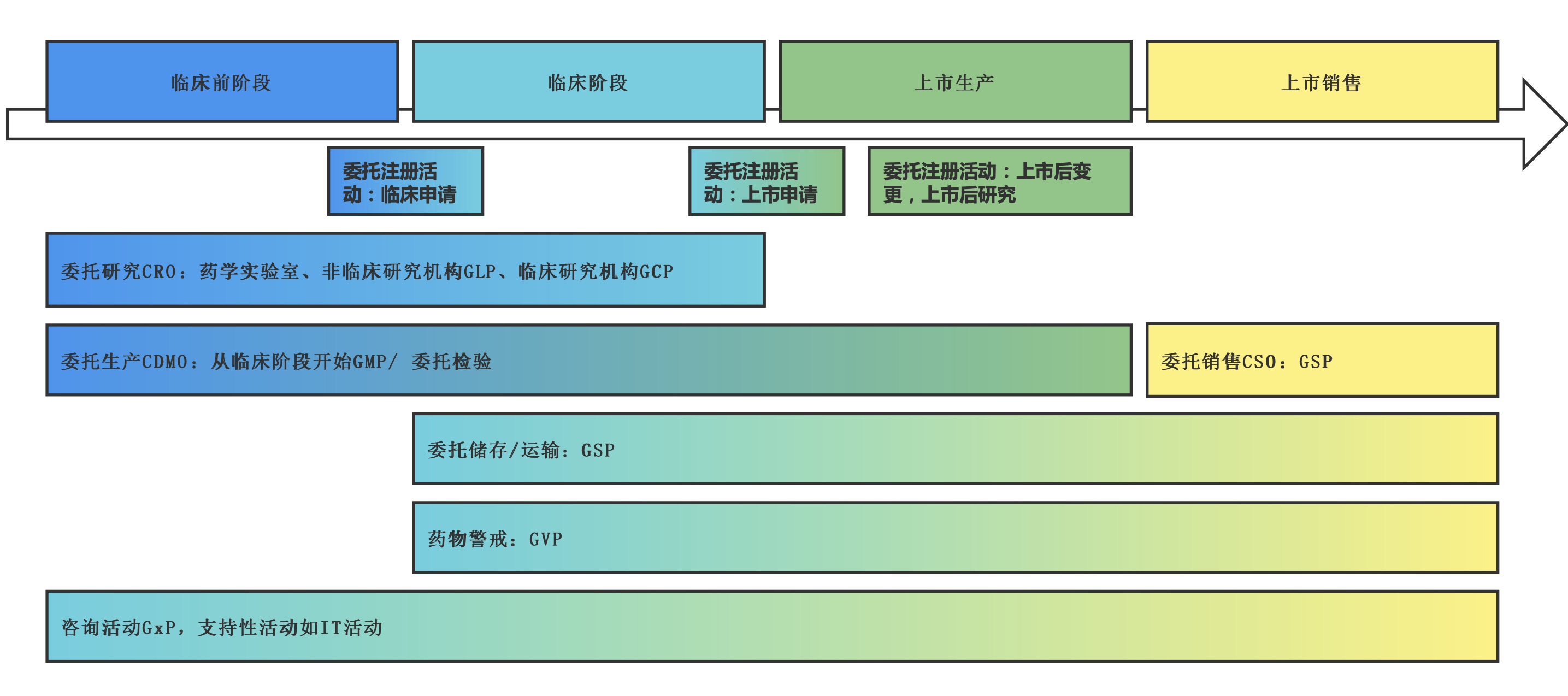
图4 MAH的外包活动
主要外包工作如下:
以上为本期MAH体系范畴包含的内容。如果您有MAH方面的困扰或上述的MAH外包服务需求,欢迎联系德恩GMP咨询,我们也提供相应的GMP咨询和陪伴式服务,解决企业面临的相对应难题。为企业在人力及技术上提供MAH支持和协助,确保企业通向成功之路!
相关资料
1. 《药品管理法(2019年版)》.