#LIMS #实验室信息管理系统 #计算机化系统
导读
LIMS(Laboratory Information Management System)实验室信息管理系统是以数据库为核心的信息化技术与实验室管理需求相结合的信息化管理系统。具体是利用计算机网络技术、数据存储技术、快速数据处理技术等,对实验室进行全方位管理的计算机软件和硬件系统[1]。LIMS基于企业的需求情况,可引入或定制开发,其目的是为了提高实验室产能和效率。比如常规的管理模块-样品管理系统,包含样品登录、样品分析、样品管理、审核系统、QA/QC等。这对于样品的管理以及后期数据的可追溯性等都有较好的效果。
本文归纳了适用LIMS法规和指南要求的内容,以及验证策略的选择。
01 适用LIMS法规和指南要求
适用于LIMS国内外主流的计算化系统的数据完整性法规和指南要求。它们主要有:
欧盟EU
欧盟药事法规 第四卷 药品生产质量管理规范,附录11:计算机化系统
欧盟药事法规 第四卷 药品生产质量管理规范,附录15:确认与验证
美国FDA
21 CFR Part 11:Electronic Records; Electronic Signatures
Guidance for Industry Part 11: Electronic Records; Electronic Signatures-Scope and Application
Data Integrity and Compliance with Drug cGMP Questions and Answers Guidance for Industry
Data Integrity and Compliance with Drug cGMP for Industry (Draft)
PIC/S
Good Practices for Computerized Systems in Regulated “GXP” Environments
Good Practices for Data Management and Integrity in Regulated GMP/GDP Environments
ICH
E6(R2) Good Clinical Practice (GCP)
Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients
ISPE
Records and Data Integrity Guide
Data Integrity-Manufacturing Records
WHO
Annex 5 Guidance on good data and record management practices
Draft Working Document for Comments: Guideline on data integrity
……
NMPA
中国《药品生产质量管理规范》(2010版)附件1:计算机化系统
药品记录与数据管理要求(试行)(2020年第74号)
02 LIMS验证策略
在讲述LIMS验证策略前,我们先了解一下LIMS的功能模块。一般情况,LIMS功能模块包含:标准库管理系统、样品管理系统、信息查询系统、实验室管理系统资源管理系统等等。具体包含的模块,依据企业实际需求引入或定制化开发。
而对于一个系统,首先我们主要考量系统本身是否有法规使用的目的。比如是否涉及到实验室控制的信息管理方面、是否涉及到仓储的信息管理方面或者物料或样本等方面。如果有,则需要开始验证和确认活动。
那么在开展验证和确认前,验证的策略如何选择呢?
首先,我们制定任何系统相应验证策略的选择时,会依据系统的生命周期模型开展相应的验证活动。具体的会根据系统特性、系统关键程度、系统用途综合分析系统存在的风险,去选择合适的验证策略。从而确保系统合规性符合预定的用途。
其次,目前,市面上的LIMS系统(不管是企业直接购买引入的或者企业定制开发的)整体按照GAMP4类或5类软件进行验证。基于系统本身特点,采用“V模型”的验证策略,总体目标是满足目标法规的符合性要求。
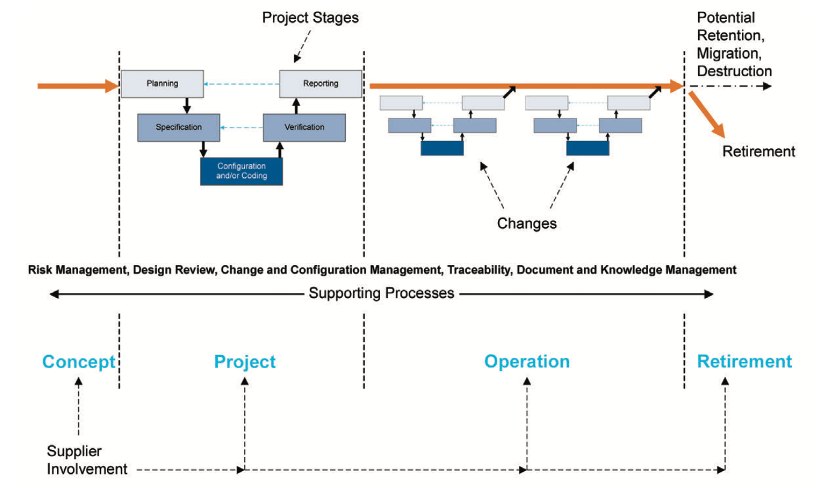
图1:生命周期模型[2]

03 LIMS验证活动流程
对于公司新增的LIMS系统,结合系统,验证与确认活动可按照以下流程开展:
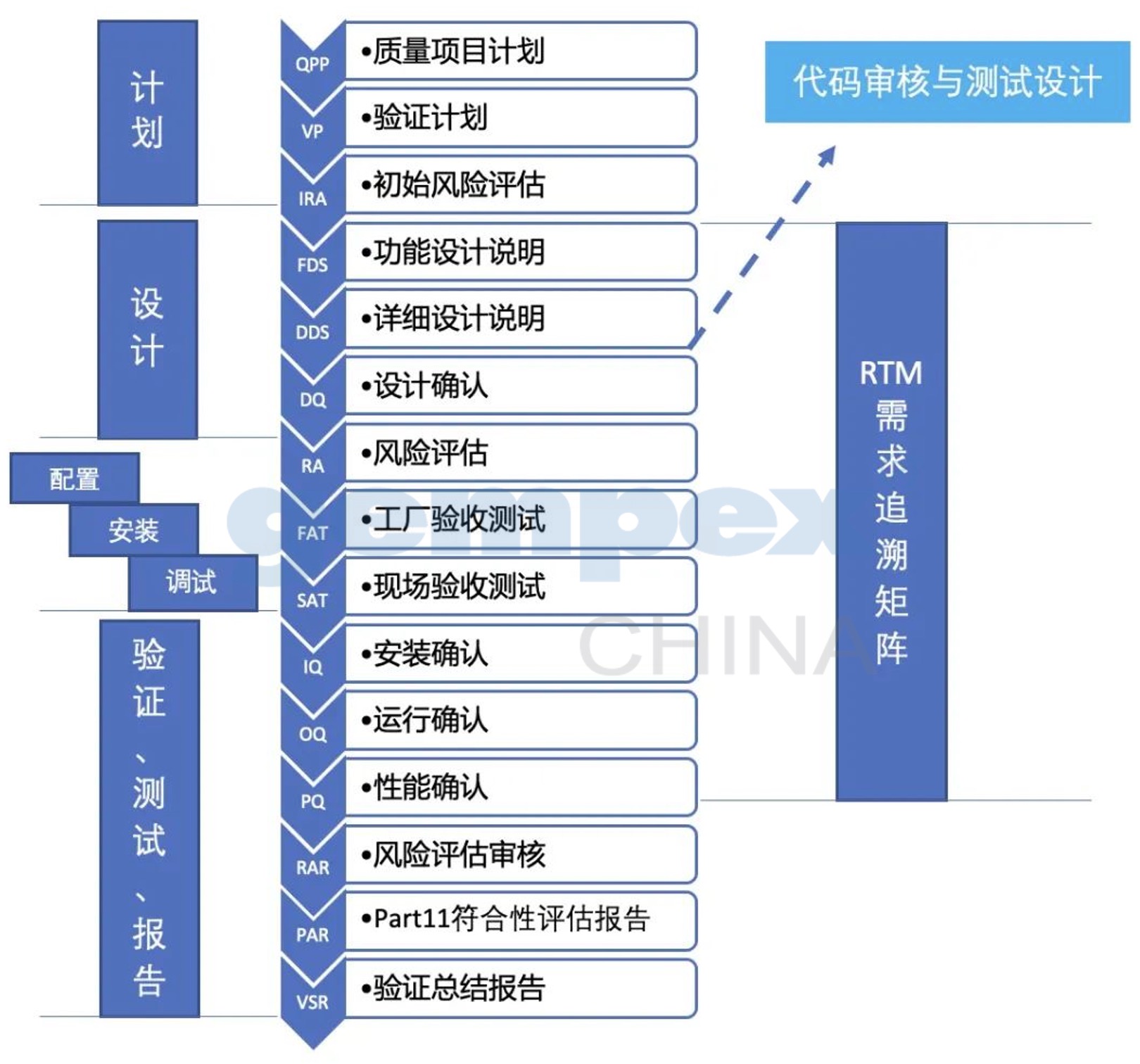
具体如何开展每个阶段的验证活动,可微信下方留言,我们在收到您的留言或需求信息后,会第一时间与您联系。赶紧和德恩的计算机化系统验证专家来一次亲密的接触吧!
参考资料
[1]百度百科.
[2]GAMP5: A Risk-Based Approach to Compliant GxP Computerized Systems. Second Edition. ISPE.2022.