2024-04-03
2024年3月29日,gempex德恩咨询的GMP专家梁奋芬先生作为特邀嘉宾应邀参与了电子资料制作实操培训,并与大家分享了“WHO药品预认证PQ”,通过介绍WHO药品预认证的流程、时间周期、费用,并结合典型案例,带大家全面了解WHO药品预认证,助力药企开展WHO预认证,保障药品顺利出口。精彩的分享获得了在场行业人士的肯定。

课程现场
下面,和小编一起来回顾本次课程分享的精彩内容吧!
01 WHO药品预审/预认证PQ简介
WHO预认证(Prequalification)成立于2001年,是世卫组织开展的一个服务项目,评估医药产品的质量、安全性和疗效。最初是为了应对艾滋病HIV/AIDS流行病,提高向低收入国家供应药物的质量。继世卫预认证工作取得成功后,其范围即开始逐步扩大,涵盖其他治疗领域产品。由于通过WHO预认证的产品通常在全球卫生领域能得到更广泛的认可和接受,因此,WHO预认证这一活动越来越受国内广大药企所重视,也为药企开放了更大的市场,以及增加了该产品的竞争力。
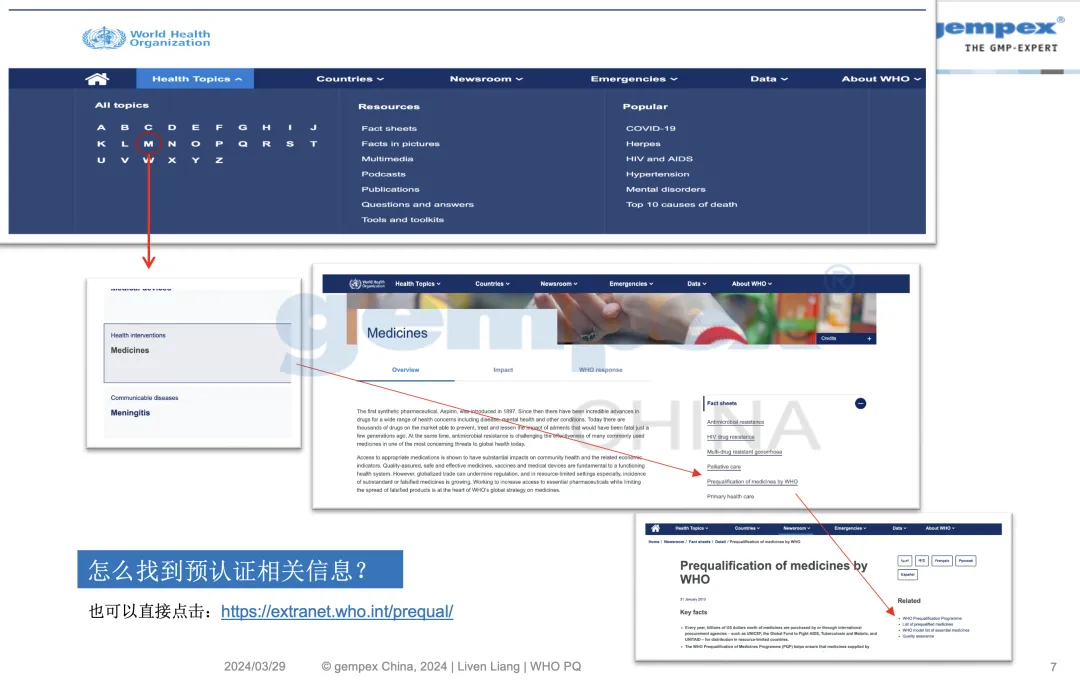
课程内容节选-WHO预认证查询渠道
02 WHO预认证工作流程、时间周期、费用
对于WHO预认证具体的认证流程和费用,世卫组织根据产品类型:药品、免疫接种设备、体外诊断试剂、疫苗和病毒控制产品进行了分类的阐述。这里我们以药品(Medicines)来进行举例说明。
药品模块预认证的对象:
首先,任何活性药物成分(API)和/或制剂(FPPs)的生产商,如其产品符合条件且有意愿接受世卫组织评估,均可以提交申请。制剂可以是仿制药和创新药以及含有一个活性成分或多个活性成分的制剂均可。负责药品化学和微生物(包括细菌内毒素)检测的实验室也有资格申请。
药品模块预认证的流程:
制剂和原料药大流程如下:
生产制造商确认其希望提交用于资格预认证的原料药或制剂包含在相关的“邀请生产制造商提交评估意向书”(EOI)中,具体可查阅:https://extranet.who.int/pqweb/medicines/products-eligible-prequalification
生产制造商根据预认证流程为其意向产品向WHO提交申请;
世卫组织查阅内部的筛选清单,对提交评估的信息进行筛选以进行资格预审;
内部核查档案清单,是在分配世卫组织参考编号前确认其产品符合要求并确认是否接受全面评估。该清单提供了哪些方面被认为是评估的关键要素,核查过程可能会需要生产制造商提供额外信息;
若递交申请的产品已经在更高标准的法规市场批准了,那么申请人可以选择递交简略评估申请;
对产品档案及生产商(原料药及制剂)以及临床试验地(比如CRO)的WHO的相关规范的符合性进行评估,如现场检查。

课程内容节选-EOI的相关指南

课程内容节选-药品模块预认证流程
03 WHO预认证如何开展准备工作?
了解完WHO预认证的整一流程,那么对于其中重要环节之一WHO的检查,我们应该如何做好准备工作呢?
迎检前药企应做好规划,在距离官方检查大约5个月前,企业应开始做好准备,进行差距分析、整改完善和模拟检查,从而做好最佳状态迎接官方检查,这样的准备可增加后面的官方检查零缺陷通过的概率。
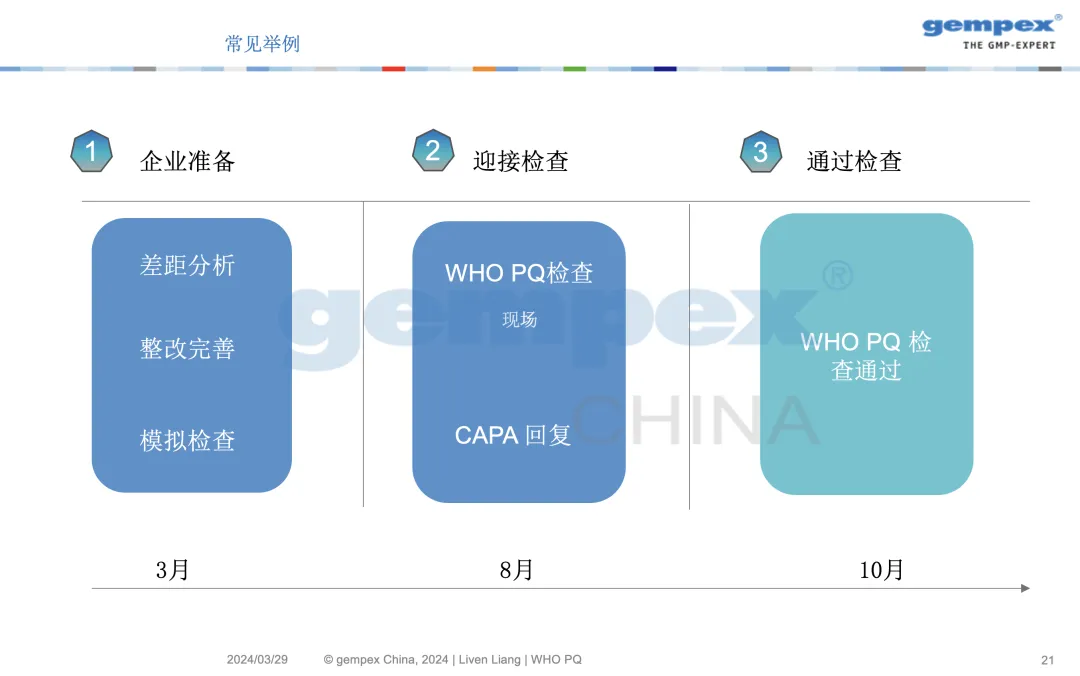
课程内容节选-检查前后的工作
以上是对“WHO药品预认证PQ”课程的精彩内容回顾。
04 分享获赠讲义
如您需要课程讲义,可在gempex德恩的邮箱info-cn@gempex.com留言,我们将在三个工作日内给您发出讲义。