SaaS,CSV,GMP合规,GMP认证,制药合规,制药行业,药品监管,质量管理,德恩咨询,gempex
导言:本文将围绕SaaS验证的要点展开深度解读,帮助药企与计算机化系统供应商快速掌握SaaS软件的验证逻辑。
SaaS vs 传统系统的差异
SaaS(软件即服务)因低初始成本和运维外包特性被制药业广泛采用。传统软件“交付即结束”,而SaaS更强调 “服务即过程” 。与传统软件相比,SaaS验证及合规需重点关注以下几个方面:
SaaS验证6大关键阶段
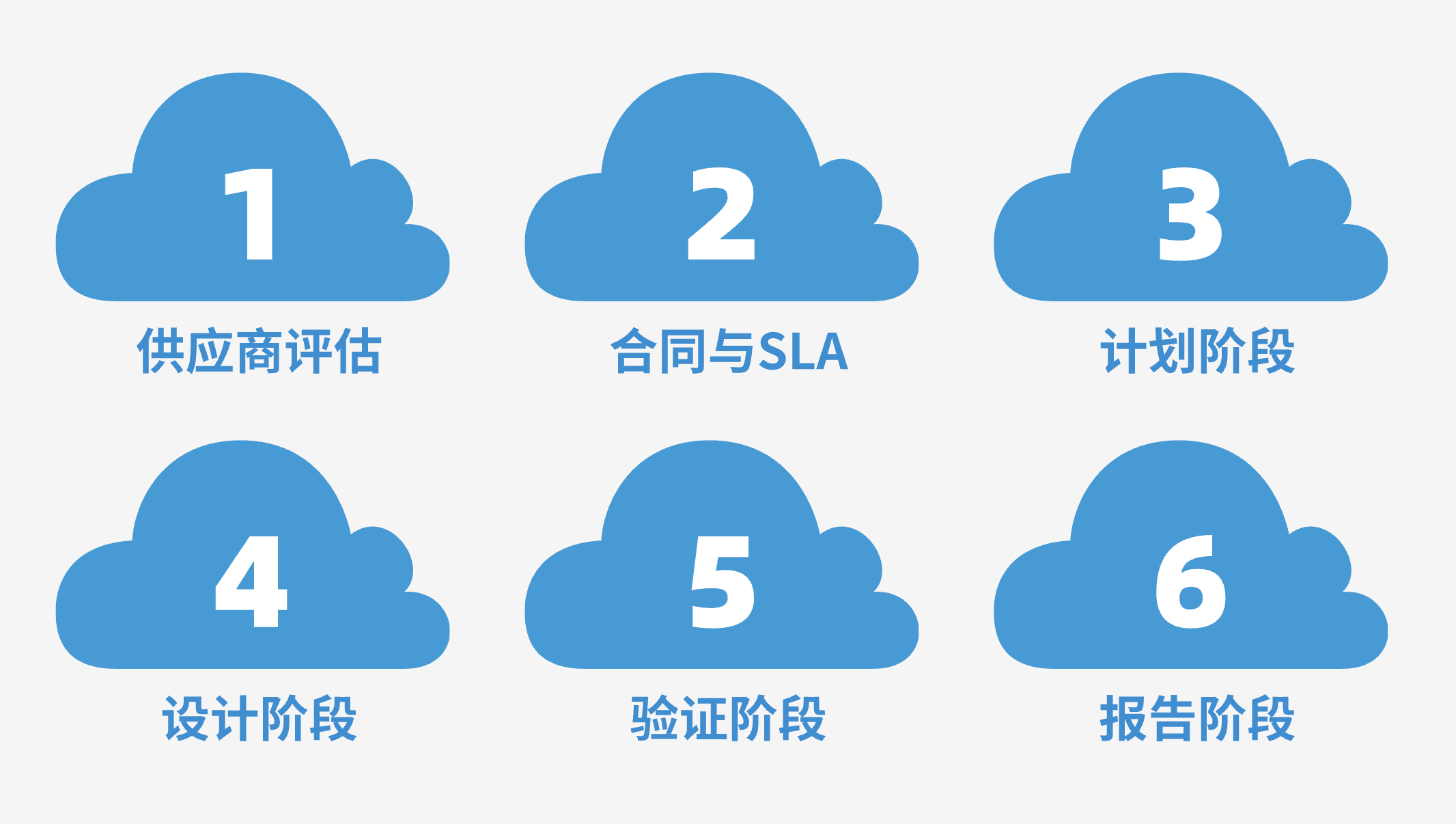
1. 供应商评估
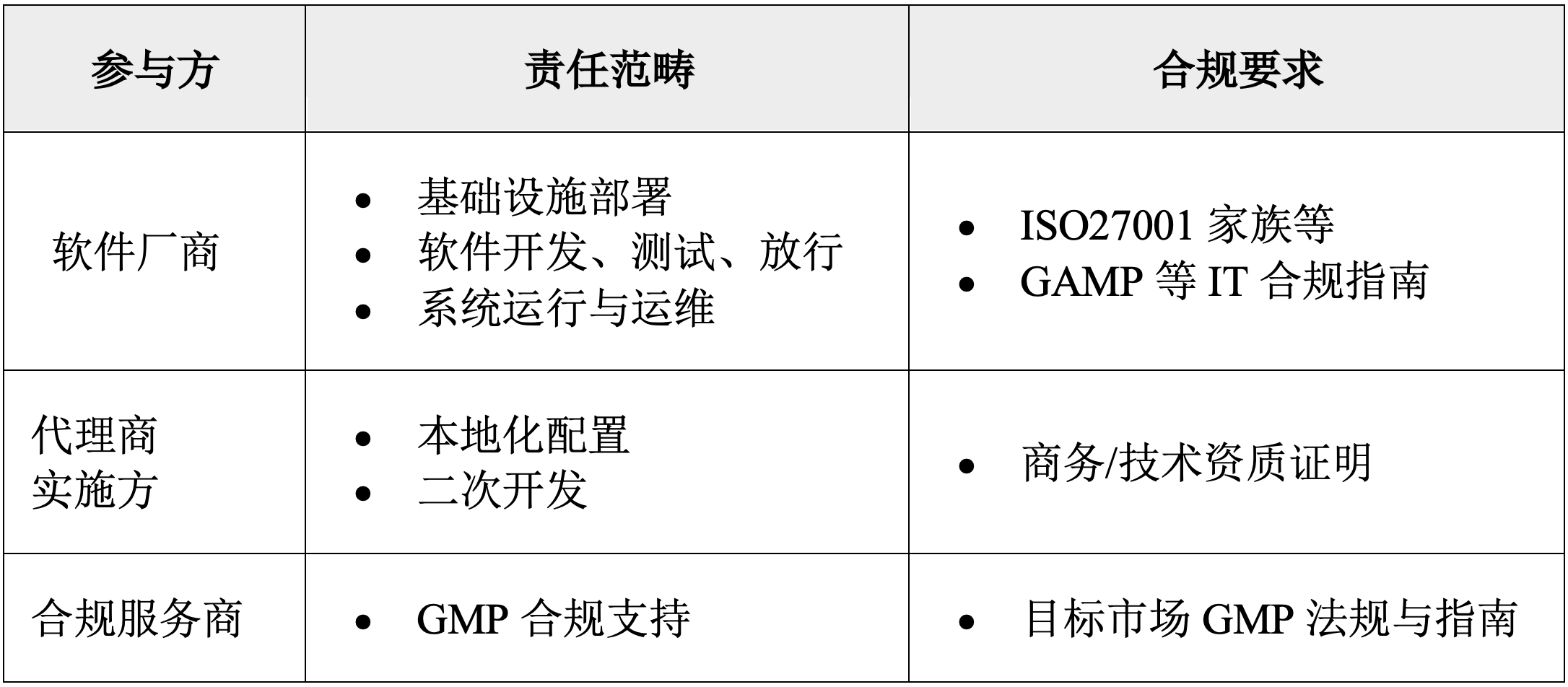
SaaS项目常见的供应商及评估考虑如下:
专家提示:
⑴ 企业应优先选择经认证的供应商,常见包括以下:
⑵ SOC2审计以评估安全和隐私为导向,尤其是Type II,因包含运行有效性验证,普遍被视为更高阶的合规成就,也是高敏感行业合作的准入门槛。这类审计报告可以在风险评估、系统设计以及测试验证过程引用和说明。
2. 合同与SLA
SaaS软件在验证交付后,企业通常只开展业务层面活动,运维工作依赖于供应商。因此SaaA验证需要关注合同与SLA,重点包括:
3. 计划阶段
验证和质量项目计划需覆盖多方协作流程,明确厂商、企业、第三方的职责边界,避免责任模糊地带过。
4. 设计阶段
企业应结合SAAS软件特性和项目实际,建立完整的系统设计信息,包括:
专家提示:可以考虑引用权威证据,例如引用供应商的SOC 2审计报告证明系统和数据安全设计有效性。
5. 验证阶段
完整的验证包需要包括:
结合产品特性,一些供应商会对标准功能进行测试和验证,以高效的方式,为多个企业进行验证支持。这种情况下,企业需要关注对文件的审核,确保测试是充分的,并保留适当的证据。
6. 报告阶段
验证报告应结合验证计划,汇总各参与方验证文件,评估系统整体合规性,并开展系统放行。
运行
企业需要按照SLA持续监控供应商活动,评估供应商的表现,并保留文件化证据,确保在供应商支持下,可以达到合规性。
总结
掌握SaaS验证的4个关键点:
如果您想了解更多GMP解决方案,可以访问www.gempexchina.com/gmp-knowledge获取。在那里,您将更深入了解gempex德恩咨询的GMP服务。
如果您有具体的合规难题,请通过以下方式联系我们。
热线:400 166 2002
邮箱:info-cn@gempex.com
关于gempex德恩咨询
gempex德恩咨询深耕GMP合规领域23年,致力于为全球的生命科学企业提供合规、高效及可执行的GMP解决方案,帮助制药、生物技术、原料药、化学、医疗器械、原辅包和化妆品等各方达到GMP标准,减少合规及药品安全风险。
目前,我们拥有60多位经验丰富的GMP专家,全球累计执行项目超过5000个,累计为1000多个客户提供专业服务,业务遍布20多个国家,并与众多知名药企建立了长期的合作关系。